题目内容
A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4.请回答:
(1)若Y是黄绿色气体,则该反应的离子方程式是 ;将Y与等物的量的SO2充分混合后通入品红溶液,未见其褪色,原因是 (请用化学方程式解释说明).
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应所得的氧化产物的结构式为 .
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,而且A可溶于X溶液中:
A元素的元素符号为 ,则A与B的反应中氧化剂与还原剂的物质的量之比是 .
(1)若Y是黄绿色气体,则该反应的离子方程式是
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应所得的氧化产物的结构式为
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,而且A可溶于X溶液中:
A元素的元素符号为
考点:无机物的推断
专题:
分析:(1)若Y是黄绿色气体为Cl2,A、B的物质的量之比为1:4,应是二氧化锰与浓盐酸制备氯气;氯气与等物质的量的二氧化硫1:1反应生成硫酸和氯化氢;
(2)若A为非金属单质,原子核外最外层电子数是次外层电子数的2倍为C,B的溶液为浓硫酸,应是碳与浓硝酸反应,化学方程式为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,氧化产物为CO2;
(3)A为金属单质,常温下A在B的浓溶液中“钝化”,则A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水;
(2)若A为非金属单质,原子核外最外层电子数是次外层电子数的2倍为C,B的溶液为浓硫酸,应是碳与浓硝酸反应,化学方程式为:C+4HNO3(浓)
| ||
(3)A为金属单质,常温下A在B的浓溶液中“钝化”,则A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水;
解答:
解:(1)若Y是黄绿色气体为Cl2,A、B的物质的量之比为1:4,应是二氧化锰与浓盐酸制备氯气,反应离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;SO2+Cl2+2H2O=H2SO4+2HCl,二氧化硫和氯气按照1:1恰好反应生成硫酸和盐酸,通入品红溶液,溶液不褪色;
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;SO2+Cl2+2H2O=H2SO4+2HCl,二氧化硫和氯气按照1:1恰好反应生成硫酸和盐酸,通入品红溶液,溶液不褪色;
(2)若A为非金属单质,原子核外最外层电子数是次外层电子数的2倍为C,B的溶液为浓硫酸,应是碳与浓硝酸反应,化学方程式为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,氧化产物为CO2,其结构式为O=C=O,
故答案为:O=C=O;
(3)A为金属单质,常温下A在B的浓溶液中“钝化”,则A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水,Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,A与B的反应中氧化剂与还原剂的物质的量之比1:1;铁为26号元素,在在元素周期表中的第四周期Ⅷ族,A为Fe;
故答案为:Fe,1:1;
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)若A为非金属单质,原子核外最外层电子数是次外层电子数的2倍为C,B的溶液为浓硫酸,应是碳与浓硝酸反应,化学方程式为:C+4HNO3(浓)
| ||
故答案为:O=C=O;
(3)A为金属单质,常温下A在B的浓溶液中“钝化”,则A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水,Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,A与B的反应中氧化剂与还原剂的物质的量之比1:1;铁为26号元素,在在元素周期表中的第四周期Ⅷ族,A为Fe;
故答案为:Fe,1:1;
点评:本题考查无机物推断,属于开放性题目,需要学生熟练掌握元素化合物性质,题干分析判断和物质性质是解题关键,难度中等.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、含有碳碳双键的有机物均有顺反异构 |
| B、乙烯和聚乙烯均能使酸性KMnO4溶液褪色 |
| C、利用电石与水反应制取C2H2时,可采用CuSO4溶液除去杂质气体 |
| D、苯酚与甲醇在酸性条件下聚合生成酚醛树脂 |
用惰性电极实现电解,下列说法正确的是( )
| A、电解NaNO3溶液,在阴极上和阳极上析出产物的物质的量之比为2:1 |
| B、电解CuSO4溶液一段时间后,再加入一定质量Cu(OH)2,溶液能与原溶液完全一样 |
| C、电解硫酸钠溶液时,Na+向阳极移动 |
| D、电解KOH溶液,实质上是电解水,故溶液pH不变 |
水的电离过程为H2O?H++OH-,在25℃、35℃时其离子积分别为K(25℃)=1.0×10-14、K(35℃)=2.1×10-14,则下列说法中正确的是( )
| A、水的电离度α(25℃)>α(35℃) |
| B、c(H+)随着温度的降低而升高 |
| C、在35℃时,纯水中c(H+)>c(OH-) |
| D、水的电离过程是吸热过程 |
 (1)维生素C的结构简式是
(1)维生素C的结构简式是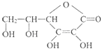 ,维生素C的分子式是
,维生素C的分子式是