题目内容
8.下列说法错误的是( )| A. | 二氧化碳和环氧丙烷在催化作用下可生成一种可降解的高聚物,可减少二氧化碳对环境的影响 | |
| B. | 化石燃料的燃烧和含硫金属矿石的冶炼等都是造成SO2污染的重要原因 | |
| C. | 氟氯烃的大量使用会破坏臭氧层,火箭、导弹将大量废气排放到高空,也会加速臭氧分解 | |
| D. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
分析 A.二氧化碳和环氧丙烷反应生成可降解聚碳酸酯;
B.二氧化硫来源于化石类燃料的燃烧、含硫矿石的冶炼;
C.氟利昂能使臭氧生成氧气;
D.酶是蛋白质升高温度酶要发生变性.
解答 解:A.二氧化碳和环氧丙烷在催化剂作用下生成可降解聚碳酸酯,故A正确;
B.化石类燃料的燃烧、含硫矿石的冶炼等过程是造成SO2污染的重要原因,故B正确;
C.氟利昂能使臭氧生成氧气,会破坏臭氧层,大量废气的排放也能使臭氧层出现空洞,故C正确;
D.过氧化氢酶的催化活性会受到温度的影响,温度过高,蛋白质变性,失去催化效力,故D错误;
故选:D.
点评 本题为综合题,涉及环境污染与保护,蛋白质的性质,熟悉生活中常见的环境污染与治理是解题关键,注意高温可以使蛋白质变性,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
18.下列微粒中,电子层结构完全相同的是( )
| A. | O2-、Cl-、K+ | B. | Cl-、Na+、Al3+ | C. | Na+、Mg2+、F- | D. | O2-、Mg2+、Cl- |
19.下列不属于有机物的是( )
| A. | CO | B. | CH4 | C. | CH3CH3 | D. | CH2=CH2 |
3.苯分子实际上不具有碳碳单键和碳碳双键的简交替结构,下面是某同学收集的有关事实,其中可以作为证据的有( )
①苯的间位二元取代物只有一种;②苯的邻位二元取代物只有一种;③苯不能使酸性KMnO4溶液褪色;④苯不能与溴水反应.
①苯的间位二元取代物只有一种;②苯的邻位二元取代物只有一种;③苯不能使酸性KMnO4溶液褪色;④苯不能与溴水反应.
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | 全部 |
13.下列醇经催化氧化的产物是 的是( )
的是( )
 的是( )
的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
20.常温下,下列各组离子一定能在指定溶液由大量共存的是( )
| A. | 使甲基橙变红色的溶液中:Na+、Fe2+、MnO4-、AlO2- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | pH=0的溶液中:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | 加入Mg能放出H2的溶液中:Ca2+、NH4+、ClO-、NO3- |
7.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如表(KMnO4溶液已酸化),实验装置如图1:
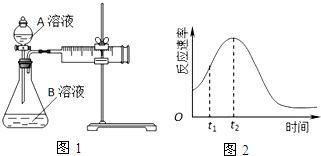
(1)该反应的离子方程为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.(已知H2C2O4是二元弱酸)
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填实验序号).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol•L-1.(假设混合溶液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.(一条即可)
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:
①该反应放热;
②产物Mn2+是反应的催化剂.

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
| ② | 20mL 0.2mol•L-1H2C2O4溶液 | 30mL 0.01mol•L-1KMnO4溶液 |
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填实验序号).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol•L-1.(假设混合溶液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.(一条即可)
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:
①该反应放热;
②产物Mn2+是反应的催化剂.
8.除去下列物质中所含少量杂质(括号内为杂质),所选试剂和方法正确的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 过量浓溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 溴苯(溴) | 氢氧化钠溶液 | 分液 |
| D | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |