题目内容
7. 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:(1)若A为水,B为过氧化钠,C中盛有稀硫酸和FeCl2混合溶液,旋开活塞E后,C中溶液颜色变化为溶液由浅绿色逐渐变为(棕)黄色
烧瓶中发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑
(2)若A为盐酸、B为大理石(主要成分为CaCO3粉末)、C中盛有水玻璃,则小试管中的现象是生成白色沉淀,固体的主要成分为(写化学式)H2SiO3.
(3)利用上述装置可以验证SO2的性质,若A为浓硫酸,B为亚硫酸钠粉末,那么C中盛有品红溶液时可验证其具有漂白性;而C中盛有氯水(或溴水或酸性高锰酸钾溶液)溶液时可验证其具有还原性(各填一种物质名称).
分析 (1)水与过氧化钠反应生成氢氧化钠和氧气,氯化亚铁具有强的还原性,能够被氧气氧化生成氯化铁;
(2)盐酸与碳酸钙反应生成二氧化碳,碳酸的酸性强于硅酸,二氧化碳与硅酸钠溶液反应生成硅酸;
(3)SO2具有还原性,可与氯水等氧化性物质反应,SO2具有漂白性,可使品红褪色.
解答 解:(1)解:过氧化钠与水反应生成氧气,化学方程式:2Na2O2+2H2O=4NaOH+O2↑,氧气能氧化具有还原性的FeCl2生成三价铁离子,溶液由浅绿色逐渐变为(棕)黄色;
故答案为:溶液由浅绿色逐渐变为(棕)黄色;2Na2O2+2H2O=4NaOH+O2↑;
(2)若A为盐酸、B为大理石(主要成分为CaCO3粉末)、C中盛有水玻璃,则盐酸与碳酸钙反应生成二氧化碳,二氧化碳与硅酸钠溶液反应生成白色的硅酸沉淀,化学式为:H2SiO3;
故答案为:生成白色沉淀; H2SiO3;
(3)SO2具有漂白性,可使品红褪色,所以C中应盛有品红;SO2具有还原性,可与氯水(或溴水或酸性高锰酸钾溶液)等氧化性物质反应,使其褪色;
故答案为:品红 氯水(或溴水或酸性高锰酸钾溶液).
点评 本题考查了元素化合物知识,明确常见元素化合物的性质是解题关键,题目难度不大,注意对基础知识的巩固.

练习册系列答案
相关题目
17.若NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 0.lmol氯气与铁反应,转移0.2NA电子 | |
| B. | 0.lmol过氧化钠与水反应,转移0.2NA电子 | |
| C. | 0.lmol铁与高温水蒸汽反应,转移0.3NA电子 | |
| D. | 0.lmol二氧化锰与足量浓盐酸反应,有0.4NA Cl-被氧化 |
18.下列有关命名的说法正确的是( )
| A. | 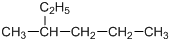 主链上的碳原子数是5 主链上的碳原子数是5 | B. |  名称是3甲基2丁烯 名称是3甲基2丁烯 | ||
| C. | 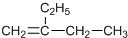 加氢后可以得到3-甲基戊烷 加氢后可以得到3-甲基戊烷 | D. | 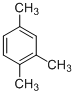 的名称是1,3,4-三甲基苯 的名称是1,3,4-三甲基苯 |
15.下列说法或表示正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B时△H=+119 kJ/mol 可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ | |
| D. | 在101kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,则H2在101kPa时的燃烧热为571.6kJ/mol |
2.下列叙述正确的是( )
| A. | 常温常压下,1.5 mol N2的体积约为33.6 L | |
| B. | NaOH的摩尔质量是40 g | |
| C. | 150mL 1 mol/LNaCl溶液与100mL 1 mol/LAlCl3溶液中的n(Cl-)相等 | |
| D. | 同温同压下,相同体积的C12和SO2气体所含的分子数一定相同 |
12.铁钉和碳棒用导线连接,浸入稀NaCl溶液中,正极发生的反应是( )
| A. | 2H++2e-═H2↑ | B. | 2H2O+O2+4e-═4OH- | ||
| C. | Fe-2e-═Fe2+ | D. | 4OH--4e-═2H2O+O2↑ |
16.将SO2通入BaCl2溶液至饱和,未见沉淀,继续通入某气体仍无沉淀,则该气体可能是( )
| A. | Cl2 | B. | NH3 | C. | NO2 | D. | CO2 |
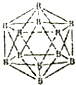 晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图).若其中有两个原子为10B,其余为11B,则该结构单元结构类型有( )
晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图).若其中有两个原子为10B,其余为11B,则该结构单元结构类型有( )