题目内容
14.写出下列反应的化学方程式:(1)红热的木炭和浓硝酸C+4HNO3(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O
(2)实验室制氨气Ca(OH)2+2NH4Cl$\frac{\underline{\;加热\;}}{\;}$CaCl2+2NH3↑+2H2O
(3)工业上制漂白粉2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O
(4)氨的催化氧化4NH3+5O2$\frac{\underline{\;催化剂\;}}{\;}$4NO+6H2O
(5)铜和浓硫酸加热Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O.
分析 (1)C和浓硝酸反应时,碳做还原剂被氧化为二氧化碳,浓硝酸被还原为NO2,据此分析;
(2)实验室用固体氯化铵和氢氧化钙混合加热来制取氨气;
(3)工业上用氯气和石灰乳反应制取漂白粉;
(4)氨气和氧气在催化剂的条件下反应生成NO和水;
(5)浓硫酸具有强的氧化性,能和金属铜在加热条件下反应.
解答 解:(1)C和浓硝酸反应时,碳做还原剂被氧化为二氧化碳,浓硝酸被还原为NO2,故化学方程式为:C+4HNO3(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O;
(2)实验室用固体氯化铵和氢氧化钙混合加热来制取氨气,反应的方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;加热\;}}{\;}$CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;加热\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)漂白粉的主要成分为CaCl2和Ca(ClO)2,工业上制取漂白粉,利用氯气与石灰乳反应,化学方程式为2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,HClO具有漂白性,用漂白粉漂白时,发生Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO,
故答案为:2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;
(4)氨气和氧气在催化剂的条件下反应生成NO和水,化学方程式为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{\;}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{\;}$4NO+6H2O;
(5)浓硫酸具有强的氧化性,能和金属铜在加热条件下反应,即:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O.
点评 本题考查了常见的化学方程式的书写,难度不大,掌握物质的性质并会分析反应的类型和产物是解题的关键.

 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案| A. | 检查是否漏水是滴定管、容量瓶、分液漏斗等仪器使用的第一步操作 | |
| B. | 碘水中加CCl4振荡静置后,上层为紫色,下层几乎为无色 | |
| C. | 可用加热法分离NH4Cl(s)和I2(s) | |
| D. | 蒸馏、分馏和干馏都是利用组分沸点不同而分离的方法 |
| A. | 在空气中切开金属钠,光亮表面变暗:2Na+O2═Na2O2 | |
| B. | 向氯化铝溶液中加入过量氨水,产生白色沉淀:Al3++3OH-═Al(OH)3 | |
| C. | 将铁粉与水蒸气共热,产生气体:2Fe+3H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2↑ | |
| D. | Al2O3 粉末溶于 NaOH 溶液中:Al2O3+2OH-═2AlO2-+H2O |
| A. | 表示组成分子中的各原子在空间的位置 | |
| B. | 以共价键相连的两原子间总以一条短线相连 | |
| C. | 结构式和球棍模型在表示分子结构上作用相同 | |
| D. | 用一条短线表示一对共用电子对的图式反映共价分子中各原子的连接顺序 |
| A. | 大量排放含氮、磷的生活污水可使水体富营养化 | |
| B. | “曾青得铁,则化为铜”是描述金属间的置换反应 | |
| C. | 光化学姻雾的形成主要与硫氧化物的排放有关 | |
| D. | 硅是光伏太阳能电池的光电半导体材料 |
| X | Y | |||
| Z | W | Q |
| A. | 离子半径的大小顺序为r(Q-)>r(W2-)>r(Z3+)>r(Y2-) | |
| B. | X、Q的氢化物化合的产物中既含共价键又含离子键 | |
| C. | Y氢化物的沸点比W氢化物的沸点高 | |
| D. | X、Z、W、Q的最高价氧化物对应的水化物均能与强碱反应 |
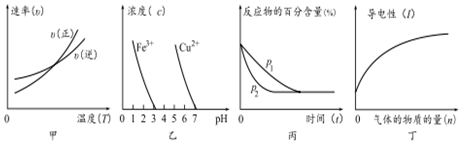
①根据图甲可判断反应的△H<0
②根据图乙,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
③图丙可表示压强(p)对反应2A(g)+2B(g)?3C(g)+D(s)的影响
④图丁可表示向醋酸溶液中通入氨气时,溶液导电性随氨气量的变化的愔况.
| A. | ①③ | B. | ②④ | C. | ③④ | D. | ①② |
| A. | 44.43KJ | B. | 88.85kJ | C. | 133.28KJ | D. | 177.70kJ |

 ;
;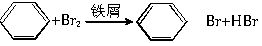 .
.