��Ŀ����
1�� ��ѧ��Ӧ�����뻯ѧƽ��
��ѧ��Ӧ�����뻯ѧƽ����һ�����º����£���2molA�����2molB����ͨ�����Ϊ2L���ܱ������з������·�Ӧ��2A��g��+B��g��?x C��g��+2D��s����2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2mol B�������C��Ũ��Ϊ1.2mo1•L-1��
��1���ӿ�ʼ��Ӧ���ﵽƽ��״̬��A���ĵ�ƽ����Ӧ����Ϊ0.4mol/��L•min����
��2��x=3��
��������Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ�Ϻϳɼ״��ķ�Ӧԭ��Ϊ��CO��g��+2H2��g���TCH3OH��g����H��
�±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
����300��ʱ����2mol CO��3mol H2��2mol CH3OH�����ݻ�Ϊ1L���ܱ������У���ʱ��Ӧ��A��
A�����������ƶ� B�����淽���ƶ� C������ƽ��״̬ D�����ж�
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ƶı��У�
| ��ʵ���� | ��T���棩 | $\frac{n��CO��}{n��{H}_{2}��}$ | ��P��MPa�� |
| ��i | ��150 | $\frac{1}{3}$ | ��0.1 |
| ��ii | 150 | $\frac{1}{3}$ | 5 |
| ��iii | ��350 | $\frac{1}{3}$ | ��5 |
��������ƽ����ϵ��CaCO3��s��?CaO��s��+CO2��g���н�����CaCO3��CaO��CO2��ԭѹǿΪp�����ΪV����t0ʱ�䣬�����������СΪԭ����һ�벢���ֲ��䣮��������ռ����ɺ��ԣ����¶�ά�ֲ��䣬�ڷ����л���t0ʱ�̺���ϵ��ѹǿ��p�����꣩��ʱ�䣨t�����꣩�Ĺ�ϵͼ��
���� ��һ�����ݻ�ѧƽ������ʽ��ʽ���㣬C�����ʵ���=1.2mol/L��2L=2��4mol��
2A��g��+B��g��?xC��g��+2D��s����
��ʼ����mol�� 2 2 0 0
�仯����mol�� 1.6 0.8 0.8x 1.6
ƽ������mol�� 0.4 1.2 2.4 1.6
0.8x=2.4��x=3������v��A��=$\frac{��c}{��t}$���㣻
��1��������ƽ�ⳣ�����¶ȱ仯�������¶�Խ��ƽ�ⳣ��ԽС��˵��ƽ��������У�
������Ũ���̺�ƽ�ⳣ���ȽϷ����жϷ�Ӧ���еķ���
��������1�����ɱ������ݿ�֪���¶�Խ�ߣ�ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�ƶ������ݷ�Ӧ�Է����е��ж����ݷ�����
�ڼ����ʱ��Ũ����Qc����ƽ�ⳣ���Ƚϣ��жϷ�Ӧ���еķ���
�۸�ͬѧͨ�������Ʊ�������̽����������Ի�ѧƽ���Ӱ�죬̽����ǰ��ֻ���Ǹı�һ���������������������䣬�ݴ˽��
�������¶Ȳ��䣬��ѧƽ�ⳣ�����䣬�������̼Ũ�Ȳ��䣬����PV=nRT�ж�ƽ������ѹǿ��
��� �⣺��һ�����ݻ�ѧƽ������ʽ��ʽ���㣬C�����ʵ���=1.2mol/L��2L=2��4mol��
2A��g��+B��g��?xC��g��+2D��s����
��ʼ����mol�� 2 2 0 0
�仯����mol�� 1.6 0.8 0.8x 1.6
ƽ������mol�� 0.4 1.2 2.4 1.6
0.8x=2.4��x=3��
��1������v��A��=$\frac{��c}{��t}$��֪��A���ĵ�ƽ����Ӧ����Ϊ$\frac{\frac{1.6mol}{2L}}{2min}$=0.4mol/��L•min����
�ʴ�Ϊ��0.4mol/��L•min����
��2��������ķ�����֪��x=3��
�ʴ�Ϊ��3��
��������1�����ɱ������ݿ�֪���¶�Խ�ߣ�ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�ƶ���������ӦΪ���ȷ�Ӧ������H��0��CO��g��+2H2��g��?CH3OH��g������Ӧ��H��0����S��0�����ݷ�Ӧ�Է����У���H-T��S��0�����������·�Ӧ�Է����У�
�ʴ�Ϊ�������ϵͣ�
�ڡ���2mol CO��3mol H2��2mol CH3OH�����ݻ�Ϊ1L���ܱ������У���ʱ��Ũ����Qc=$\frac{2}{2��3{\;}^{2}}$=$\frac{1}{9}$��С��0.27���ʷ�Ӧ������Ӧ���У�
�ʴ�Ϊ��A��
��ͨ�������Ʊ�������̽����������Ի�ѧƽ���Ӱ�죬̽����ǰ��ֻ���Ǹı�һ���������������������䣬�ɴ˿ɵã�ii���¶�AΪ150�棬n ��CO��/n��H2��BΪ$\frac{1}{3}$��DΪ5��iii��n ��CO��/n��H2��CΪ$\frac{1}{3}$��
�ʴ�Ϊ��150��$\frac{1}{3}$��5��$\frac{1}{3}$��
�������¶Ȳ��䣬��ѧƽ�ⳣ�����䣬�������̼Ũ�Ȳ��䣬����PV=nRT֪��P=$\frac{n}{V}$RT=CRT���¶Ȳ��䣬R�dz�����C���䣬��P���䣬����t0ʱ�̺���ϵ��ѹǿ��p�����꣩
��ʱ�䣨t�����꣩�Ĺ�ϵͼΪ�� ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼���˻�ѧƽ�⡢ƽ�ⳣ��Ӱ�����ط����жϣ�ƽ���־������Ӧ�ã�ע���Чƽ��״̬�ķ���Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�ij�¶��£�H2��g��+CO2��g�� H2O��g��+CO��g����ƽ�ⳣ��K=
H2O��g��+CO��g����ƽ�ⳣ��K= �����¶����ڼס��ҡ������������ܱ������У�Ͷ��H2��g����CO2��g��������ʼŨ�������ʾ�������жϲ���ȷ���ǣ� ��
�����¶����ڼס��ҡ������������ܱ������У�Ͷ��H2��g����CO2��g��������ʼŨ�������ʾ�������жϲ���ȷ���ǣ� ��
��ʼŨ�� | �� | �� | �� |
c��H2��/mol/L | 0.010 | 0.020 | 0.020 |
c��CO2��/mol/L | 0.010 | 0.010 | 0.020 |
A�� ƽ��ʱ������CO2��ת���ʴ���60%
B�� ƽ��ʱ�����кͱ���H2��ת���ʾ���60%
C�� ƽ��ʱ������c��CO2���Ǽ��е�2������0.012mol/L
D�� ��Ӧ��ʼʱ�����еķ�Ӧ������죬���еķ�Ӧ��������
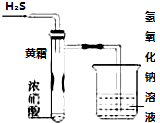 ijͬѧ������ʵ��װ��̽����������ʣ�����ͼʾ�ж����н��۲���ȷ����
ijͬѧ������ʵ��װ��̽����������ʣ�����ͼʾ�ж����н��۲���ȷ������������
| A�� | �Թ��ڱ��ϡ���˪���ijɷ����� | |
| B�� | ��ʵ��̽��˵��Ũ������������ԣ����лӷ��� | |
| C�� | �ձ��ڵ�NaOH��Һ�������dz�ȥβ������ֹβ����Ⱦ���� | |
| D�� | H2S��SO2���棬�������Է�Ӧ���� |
| A�� | �ܣ��ۣ��ڣ��� | B�� | �ۣ��ܣ��ڣ��� | C�� | �ڣ��ۣ��ܣ��� | D�� | �ۣ��ڣ��ܣ��� |
 27H2O��+10M+aAl2O3����˵����ȷ����
27H2O��+10M+aAl2O3����˵����ȷ����
 ����Ҫ��ӦΪ��2CuFeS2+4O2=Cu2S+3SO2+2FeO (¯������
����Ҫ��ӦΪ��2CuFeS2+4O2=Cu2S+3SO2+2FeO (¯������ 2Cu2O+2SO2;��2Cu2O+Cu2S=6Cu+SO2������˵��������ǣ� ��
2Cu2O+2SO2;��2Cu2O+Cu2S=6Cu+SO2������˵��������ǣ� �� +��Fe2+��Zn2+ B��ֻ�� Zn2+
+��Fe2+��Zn2+ B��ֻ�� Zn2+