题目内容
12.我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L-1.其工业提取法有:Ⅰ.空气吹出纯碱吸收法.方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴.该方法涉及的反应有:
①Cl2+2Br-═Br2+2Cl-
②3Br2+3CO${\;}_{3}^{2-}$═BrO${\;}_{3}^{-}$+5Br-+3CO2↑;
③BrO${\;}_{3}^{-}$+5Br-+6H+═3Br2+3H2O
其中②中的氧化剂是Br2,③中的还原剂是Br-.
Ⅱ.空气吹出SO2吸收法.该方法基本同(Ⅰ),只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴.
写出溴与二氧化硫反应的化学方程式Br2+SO2+2H2O=2HBr+H2SO4.
Ⅲ.溶剂萃取法.该法是利用单质溴在水中和萃取剂中溶解度的不同的原理来进行的.
实验室中萃取用到的主要实验仪器名称是分液漏斗.
下列可以用于海水中溴的萃取的试剂是②(填序号).
①乙醇 ②四氯化碳 ③硝酸.
分析 Ⅰ.氯气有强氧化性,能氧化溴离子生成溴单质,还原剂失电子化合价升高而发生氧化反应;
Ⅱ.溴有氧化性,二氧化硫有还原性,在水溶液里,二氧化硫和溴发生氧化还原反应;
Ⅲ.用于萃取实验的仪器是分液漏斗,萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在水中的溶解度,萃取剂和原溶剂不互溶,萃取剂和溶质不反应.
解答 解:Ⅰ.氯气有强氧化性,能氧化溴离子生成溴单质,自身被还原生成氯离子,离子反应方程式为:Cl2+2Br-=Br2+2Cl-;Br2+3CO32-=BrO3-+5Br-+3CO2↑中Br2的化合价由0价变为+5价和-1价,所以Br2是氧化剂发生还原反应,也是还原剂发生氧化反应,还原剂、氧化剂都为Br2,③BrO3-+5Br-+6H+═3Br2+3H2O.中的还原剂是Br-,
故答案为:Br2;Br-;
Ⅱ.溴有氧化性,二氧化硫有还原性,在水溶液里,二氧化硫和溴发生氧化还原反应生成硫酸和氢溴酸,反应方程式为:Br2+SO2+2H2O=2HBr+H2SO4;
故答案为:Br2+SO2+2H2O=2HBr+H2SO4;
Ⅲ.用于萃取实验的仪器是分液漏斗,萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在水中的溶解度,萃取剂和原溶剂不互溶,萃取剂和溶质不反应,根据萃取剂的选取标准知,乙醇、硝酸都和水互溶,所以不能作萃取剂,能作萃取剂的是四氯化碳;
故答案为:分液漏斗;②.
点评 本题以海水资源的综合利用为载体综合考查物质的分离、提纯,侧重于学生的分析、实验能力的考查,题目难度中等,涉及萃取剂的选取、氧化还原反应、等知识点,基本概念、基本理论是解答关键.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
2.下列离子方程式与所述事实相符且正确的是( )
| A. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| B. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| C. | 以铜为电极电解饱和食盐水:2 Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4 Fe2++2 Br-+3Cl2═4Fe3++6Cl-+Br2 |
7.下列说法不正确的是( )
| A. | 因为水果中一般含有各种芳香族有机酸,食用时能感到较强的酸味,刺激食欲 | |
| B. | 猪肉因含有 而有香味,该物质属于烃的衍生物,能发生加聚反应 而有香味,该物质属于烃的衍生物,能发生加聚反应 | |
| C. | 除去苯中 的方法:加溴水,充分振荡,静置分液 的方法:加溴水,充分振荡,静置分液 | |
| D. | 在分子筛固体酸作催化剂的条件下,用苯和丙烯反应制备异丙苯,符合绿色化学工艺 |
17.下列离子方式正确的是( )
| A. | 向100mL 0.1mol/L的FeSO4溶液中,加入0.01mol Na2O2固体2Fe2++2Na2O2+2H2O═4Na++2Fe(OH)2+O2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-═2C6H5OH+CO32- | |
| D. | 向40mL0.5mol/LFeBr2溶液中通入448mLCl2(标准状况):2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
4.如表实验不能达到预期目的是( )
| 序号 | 实验操作 | 实验目的 |
| A | 浓、稀HNO3分别与Cu反应 | 比较浓、稀HNO3的氧化性强弱 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| D | 测定等浓度的HCl、HNO3两溶液的pH | 比较Cl、N的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
1.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
回答下列问题:
(1)加入过量废铁屑的目的是2Fe3++Fe=3Fe2+(用离子方程式表示);加入少量NaHCO3的目的是调节pH,在pH在4.4-7.5之间将铝离子转化为Al(OH)3沉淀,而亚铁离子不能生成沉淀;该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行;
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O;该流程中可以循环、回收利用的物质是NO;
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是碱式硫酸铁受热易分解;
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为A.(填写字母)
A.酸性KMnO4溶液B.KSCN溶液 C.氯水D.NaOH溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入过量废铁屑的目的是2Fe3++Fe=3Fe2+(用离子方程式表示);加入少量NaHCO3的目的是调节pH,在pH在4.4-7.5之间将铝离子转化为Al(OH)3沉淀,而亚铁离子不能生成沉淀;该工艺中“搅拌”的作用是使反应物充分接触,加快反应速率,使反应充分进行;
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O;该流程中可以循环、回收利用的物质是NO;
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是碱式硫酸铁受热易分解;
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为A.(填写字母)
A.酸性KMnO4溶液B.KSCN溶液 C.氯水D.NaOH溶液.
2.下列关于钠元素的几种表达式错误的是( )
| A. | Na+的电子排布图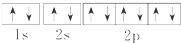 | B. | Na+的结构示意图: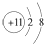 | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化的电子排布式:[Na]3s1 |
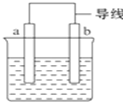 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: