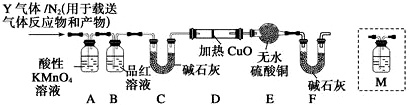
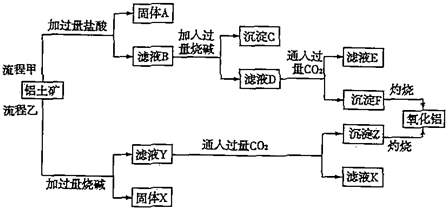
题目内容
2.下列离子方程式与所述事实相符且正确的是( )| A. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| B. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| C. | 以铜为电极电解饱和食盐水:2 Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4 Fe2++2 Br-+3Cl2═4Fe3++6Cl-+Br2 |
分析 A.NaOH完全反应,生成碳酸钙、碳酸氢钠、水;
B.发生氧化还原反应生成硝酸铁、NO和水,磁性氧化铁为四氧化三铁;
C.以铜为电极电解饱和食盐水,阳极Cu失去电子,阴极氢离子得到电子;
D.由电子守恒及氧化的先后顺序可知,亚铁离子全部被氧化,溴离子部分被氧化.
解答 解:A.Ca(HCO3)2溶液中加入少量NaOH溶液的离子反应为Ca2++HCO3-+OH-═CaCO3↓+H2O,故A错误;
B.磁性氧化铁溶于稀硝酸的离子反应为3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O,故B错误;
C.以铜为电极电解饱和食盐水的离子反应为Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2↓+H2↑,故C错误;
D.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应的离子反应为4 Fe2++2 Br-+3Cl2═4Fe3++6Cl-+Br2,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,选项D为解答的难点,题目难度不大.

练习册系列答案
 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
10.已知下列热化学方程式
C2H5OH(l)+2O2(g)═2CO(g)+3H2O(g)△H1
C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H2
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(l)△H3
C(s)+H2O(g)═CO(g)+H2(g)△H4
2C(s)+2H2O(g)═2CO(g)+2H2(g)△H5
其反应热大小关系正确的是( )
C2H5OH(l)+2O2(g)═2CO(g)+3H2O(g)△H1
C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H2
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(l)△H3
C(s)+H2O(g)═CO(g)+H2(g)△H4
2C(s)+2H2O(g)═2CO(g)+2H2(g)△H5
其反应热大小关系正确的是( )
| A. | △H3<△H2<△H1<△H4<△H5 | B. | △H1<△H2<△H3<△H5<△H4 | ||
| C. | △H4<△H5<△H1<△H2<△H3 | D. | △H4<△H5<△H3<△H2<△H1 |
7.下列各组指定的元素,不能形成AB2型化合物的是( )
| A. | 3s1和3s23p4 | B. | 3s23p4 和2s22p4 | ||
| C. | 3s2和2s22p5 | D. | 2s22p2 和2s22p4 |
14.常温下,在指定环境中,下列各组离子一定不可以大量共存的是( )
| A. | 在pH=3的溶液中:Na+、NO3-、Cl-、Al3+ | |
| B. | 使pH试纸呈红色的溶液中:Fe2+、ClO-、SO42-、Na+ | |
| C. | 由水电离出的c(H+)=10-13 mol•L-1的溶液中:CO32-、SO42-、Cl-、Na+ | |
| D. | 加入铝粉后产生大量氢气的溶液中:NH4+、Na+、SO42-、Cl- |

 ;
; ;
; (写出结构简式).
(写出结构简式).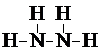 .
.