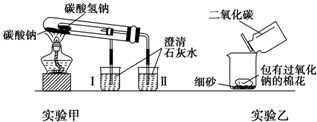
题目内容
14.根据要求填空:(1)在0.1mol/L的CH3COOH溶液中,若加入少量的蒸馏水,溶液的pH增大;若加入少量的纯醋酸,溶液中的c(CH3COO-)增大;若加入少量的NaOH固体,溶液中的c(H+)减小;若加入少量的CH3COONa固体,溶液中的c(OH-)增大.(以上均用“增大”、“减小”或“不变”填空)
(2)NH4Cl 溶液中离子浓度的由大到小的顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-).
(3)若将体积相等的HCl溶液和氨水混合,且恰好呈中性,则混合前c(HCl)<c(NH3•H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(OH-)<c(NH4+).
分析 (1)酸为弱电解质,不能完全电离,在溶液中存在电离平衡CH3COOH?CH3COO-+H+,如改变溶液中CH3COOH、CH3COO-、H+的浓度,平衡可发生移动,根据浓度对平衡移动的影响解答该题;
(2)氯化铵溶液中,铵根离子部分水解,溶液显示酸性,c(H+)>c(OH-),再结合电荷守恒判断各离子浓度大小;
(3)溶液呈中性,据电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+)可得:c(Cl-)=c(NH4+),因氨水为弱电解质,若该溶液中由体积相等的稀盐酸和氨水混合而成,则氨水应该稍过量,即:氨水浓度大于盐酸浓度;由于混合后的溶液中c(OH-)=c(H+),氢氧根离子浓度非常小,则混合液中c(OH-)<<c(NH4+).
解答 解:(1)加入一定量蒸馏水,促进醋酸的电离,平衡向右移动,n(H+)增大,n(CH3COOH)减小,但溶液体积增大,则c(H+)减小,溶液的pH增大;若加入少量的纯醋酸,CH3COOH浓度增大,平衡向右移动,则溶液中的c(CH3COO-)增大;若加入少量的NaOH固体,与醋酸发生中和反应,则溶液中的c(H+)减小;若加入少量的CH3COONa固体,溶液中c(CH3COO-)增大,平衡向左移动,溶液中的c(H+)减小,c(OH-)增大,
故答案为:增大;增大;减小;增大.(1)增大;增大;减小;增大
(2)氯化铵溶液中铵根离子部分水解:NH4++H2O=NH3•H2O+H+,则:c(H+)>c(OH-)、c(Cl-)>c(NH4+),溶液中离子浓度由大到小顺序为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-).c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(3)溶液呈中性,据电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+)可得:c(Cl-)=c(NH4+),因氨水为弱电解质,若该溶液中由体积相等的稀盐酸和氨水混合而成,则氨水应该稍过量,即:氨水浓度大于盐酸浓度;由于混合后的溶液中c(OH-)=c(H+),氢氧根离子浓度非常小,则混合液中c(OH-)<<c(NH4+),故答案为:<;<.
点评 本题考查较为综合,水解弱电解质的电离和弱电解质的电离以及离子浓度的大小比较,侧重于学生的分析能力的考查,注意把握弱电解质电离的影响因素,难度不大.

| A. | 非金属氧化物一定是酸性氧化物 | B. | 碱性氧化物一定是金属氧化物 | ||
| C. | 碱性氧化物都能与水化合生成碱 | D. | 酸性氧化物都能与水化合生成酸 |
| A. | 品红溶液褪色---漂白性 | B. | 高锰酸钾溶液褪色---漂白性 | ||
| C. | 导致酸雨---酸性氧化物 | D. | 通入H2S溶液中变浑浊---氧化性 |
| A. | 基态碳原子核外电子排布图是: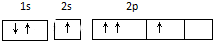 | |
| B. |  和 和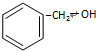 是同系物,性质相似 是同系物,性质相似 | |
| C. | 过氧化钠的电子式: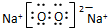 | |
| D. | 常见的化学键有:离子键、共价键、金属键、氢键等 |
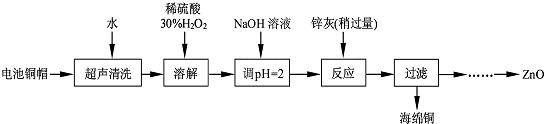
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2 反应的离子反应方程式Cu+H2O2+2H+=Cu2++2H2O;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2 2S2O32-+I2═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为蓝色褪去;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有
Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点.再重复操作实验3次,记录数据如下:
| 实验编号 | 1 | 2 | 3 | 4 |
| V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
尽,则所测定c (Cu2+)将会偏大(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀.已知KSP[Cu (OH)2]=2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)=2×10-10mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0mol•L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;③过滤;
④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;⑤过滤、洗涤、干燥;⑥900℃煅烧.
| A. | CO32-、H+、NO3-、Na+ | B. | OH-、K+、NO3-、Cl- | ||
| C. | Mg2+、H+、OH-、SO42- | D. | Na+、Cu2+、OH-、SO42- |