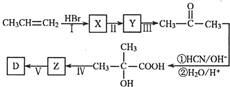
题目内容
10.固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49kJ/mol.某科学实验在一定温度下,将6molCO2和8molH2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.a,b,c,d括号内数据表示坐标.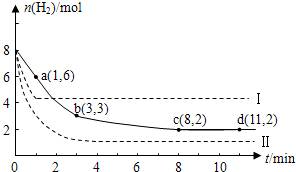
(1)0~a,a~b,b~c,c~d四段中,平均反应速率最大的时间段是0~a,该时间段内H2的平均反应速率是1mol/(L•min).
(2)a点正反应速率大于(填大于、等于或小于)逆反应速率.
(3)平衡时CO2的转化率是33.3%;反应前、后容器内的压强比是7:5.
分析 (1)a点时还没有达到平衡状态,从反应物的物质的量的变化趋势判断反应进行的方向,依次判断正逆反应速率大小,根据曲线的斜率判断,斜率越大,说明在单位时间内反应物的变化率越大,反应速率越大,也可分别计算不同时间内的反应速率大小来进行比较;
(2)根据图示a点不是平衡状态,反应继续正向进行的情况来回答;
(3)利用三段式进行计算,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始物质的量/mol 6 8 0 0
物质的量变化/mol 2 6 2 2
平衡物质的量/mol 4 2 2 2
转化率等于变化量和初始量的比值,气体压强之比等于气体物质的量之比,据此计算回答.
解答 解:(1)a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动,所以正反应速率大于逆反应速率,分别计算不同时间内的反应速率:0~1min内,v(H2)=$\frac{(8-6)mol}{2L×1min}$=1mol/(L•min);8min后达到化学平衡状态,正逆反应速率相等,综合速率为零;所以0~1min内反应速率最大,8~11min反应速率最小,
故答案为:0~a;1mol/(L•min);
(2)根据图示a点不是平衡状态,反应继续正向进行,所以正反应速率大于逆反应速率,故答案为:大于;
(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始物质的量/mol 6 8 0 0
物质的量变化/mol 2 6 2 2
平衡物质的量/mol 4 2 2 2
二氧化碳的转化率=$\frac{2mol}{6mol}$×100%=33.3%,反应前后容器内的压强比等于气体物质的量之比:P前:P后=(6+8):(4+2+2+2)=14:10=7:5;
故答案为:33%;7:5.
点评 本题考查化学反应速率或平衡的图象和热化学反应方程式,考查计算反应速率的大小比较以及反应物转化的多少,注意把握对题目图象的分析.题目较为综合,具有一定难度.

①乙烷(乙烯) 光照条件下通入Cl2,气液分离
②乙酸乙酯(乙酸) 用饱和碳酸钠溶液洗涤、分液
③苯(苯酚) 用氢氧化钠溶液洗涤、分液
④乙醇(水) 加足量生石灰、蒸馏.
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
| A. | 密度大小 | B. | 容易导电 | C. | 延展性好 | D. | 易导热 |
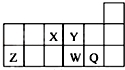
| A. | 元素Y的氢化物比元素X的氢化物稳定 | |
| B. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| C. | 离子Y2-和Z3+的核外电子数和电子层数都不相同 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
 盆烯是近年合成的一种有机物,它的分子结构可用如图表示(其中碳、氢原子均已略去),下面关于盆烯的说法错误的是( )
盆烯是近年合成的一种有机物,它的分子结构可用如图表示(其中碳、氢原子均已略去),下面关于盆烯的说法错误的是( )| A. | 盆烯的分子中所有的碳原子共一平面 | |
| B. | 盆烯是苯的一种同分异构体 | |
| C. | 盆烯与乙烯的官能团相同 | |
| D. | 盆烯可以在一定条件下发生加成反应 |
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=890.3 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
| A. | 灼热的碳与CO2的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 铝片与稀盐酸的反应 | D. | 甲烷在氧气中的燃烧反应 |
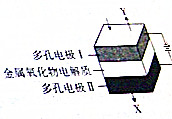
| A. | X的成分是H2和CO | |
| B. | 阳极的电极反应式为2O2--4e-=O2↑ | |
| C. | 电解质中的O2-移向电极I | |
| D. | 当阴极上有2mol气体生成时,通过电解质的电子数目为4NA |
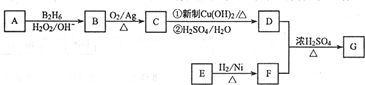
 .
. .
.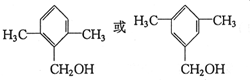 (写出一种即可).
(写出一种即可).