题目内容
18.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )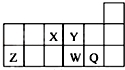
| A. | 元素Y的氢化物比元素X的氢化物稳定 | |
| B. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| C. | 离子Y2-和Z3+的核外电子数和电子层数都不相同 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
分析 由短周期元素X、Y、Z、W、Q的相对位置,可知X为N,Y为O,Z为Al,W为S,Q为Cl.
A.同周期从左向右非金属性增强,非金属性越强,对应氢化物越稳定;
B.同周期自左而右原子半径减小,一般电子层越多原子半径越大;
C.离子Y2-和Z3+的核外电子数均为10;
D.同周期从左向右非金属性增强,非金属性越强,最高价含氧酸的酸性越强.
解答 解:由短周期元素X、Y、Z、W、Q的相对位置,可知X为N,Y为O,Z为Al,W为S,Q为Cl.
A.同周期从左向右非金属性增强,非金属性Y>X,非金属性越强,对应氢化物越稳定,故A正确;
B.同周期自左而右原子半径减小,一般电子层越多原子半径越大,故原子半径rZ>rW>rQ>rX>rY,故B错误;
C.离子O2-和Al3+的核外电子数均为10,均有2个电子层,故C错误;
D.同周期从左向右非金属性增强,非金属性W<Q,非金属性越强,最高价含氧酸的酸性越强,故Q的酸性更强,故D错误.
故选:A
点评 本题考查元素周期表与元素周期律应用,侧重对元素周期律的考查,熟练掌握元素周期律表的结构.

练习册系列答案
相关题目
8.下列事实不能作为实验判断依据的是( )
| A. | 硫酸的酸性强于次氯酸,判断硫与氯的非金属性强弱 | |
| B. | 镁与铝分别与物质的量浓度相同的盐酸反应,判断镁与铝的金属活动性强弱 | |
| C. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| D. | Cl2与Br2分别与足量的H2反应,判断氯与溴的非金属性强弱 |
9.下列各组顺序的排列不正确的是( )
| A. | 离子半径:F->Na+>Mg2+>Al3+ | B. | 热稳定性:HF>H2O>H2S | ||
| C. | 还原性:F-<Cl-<I- | D. | 碱性强弱:NaOH>KOH>CsOH |
13.下列叙述正确的是( )
| A. | 非金属原子间以共价键结合的物质一定是共价化合物 | |
| B. | 凡是含有离子键的化合物一定是离子化合物 | |
| C. | 凡是能电离出离子的化合物一定是离子化合物 | |
| D. | 含有共价键的化合物一定是共价化合物 |
3.某烃的分子式为C10H14,不能使溴水褪色,但可使酸性高锰酸钾溶液褪色,分子结构中只含有一个烷基,则此烷基的结构共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
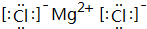 .
. .
. 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1.
,F原子的电子排布式是1s22s22p63s23p63d104s1. .DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.
.DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.