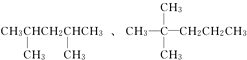题目内容
利用反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池.
①画出原电池的装置图,并标明两极材料和电解质溶液
②写出电极反应式:
负极: .
正极: .
①画出原电池的装置图,并标明两极材料和电解质溶液
②写出电极反应式:
负极:
正极:
考点:设计原电池
专题:电化学专题
分析:该反应中Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,发生氧化反应的金属Cu作负极、不如Cu活泼的金属或导电的非金属作正极,FeCl3为电解质,
据此设计原电池.
据此设计原电池.
解答:
解:(1)根据电池反应式知,Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以Cu作负极,不如铜活泼的金属或导电的非金属作正极,如C,FeCl3溶液为电解质溶液,其装置图为 ,故答案为:
,故答案为: ;
;
(2)由方程式可知,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,
故答案为:Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+.
 ,故答案为:
,故答案为: ;
;(2)由方程式可知,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,
故答案为:Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+.
点评:本题考查了原电池设计,这些新课标要求学生需要掌握的内容,正确判断原电池正负极材料、电解质溶液是设计原电池难点,一般来说,还原剂作负极,不如负极活泼的金属或非金属导体作正极,氧化剂的溶液作电解质溶液.

练习册系列答案
相关题目
下列说法正确的是( )
| A、化学反应不一定都有反应热 |
| B、使用催化剂可以改变反应的平衡常数 |
| C、升高温度使反应加快,是因为降低了反应的活化能 |
| D、对于同一个化学反应无论是一步完成还是分几步完成,其反应的焓变相同 |
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(l););△H=-57.3kJ/mol 下列结论正确的是( )
| A、稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
| B、①的反应热为221kJ/mol |
| C、稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol |
| D、碳的燃烧热大于110.5kJ/mol |
下列关于有机化合物的认识不正确的是( )
| A、盐析可提纯蛋白质并保持其生理活性 |
| B、蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 |
| C、石油分馏可获得乙烯、丙烯和丁二烯 |
| D、向澄清的苯酚钠溶液中通入二氧化碳气体,会看到澄清溶液变浑浊 |

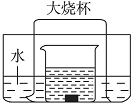 如图所示的实验装置,向盛有足量水的水槽里放两个烧杯,小烧杯里放有适量的铜片和过量的浓硝酸,小烧杯外面倒扣一个大烧杯,请回答下列问题:
如图所示的实验装置,向盛有足量水的水槽里放两个烧杯,小烧杯里放有适量的铜片和过量的浓硝酸,小烧杯外面倒扣一个大烧杯,请回答下列问题: