题目内容
进行下列化学基本量的计算,并将结果直接填入空格中.
(1)0.1摩H2SO4约含 个H原子,溶于水后电离产生 mol SO42-.
(2)36克水与 g CO2具有相同的氧原子数.
(3)71gNa2SO4中所含Na+的物质的量为 mol.
(1)0.1摩H2SO4约含
(2)36克水与
(3)71gNa2SO4中所含Na+的物质的量为
考点:物质分子中的原子个数计算,物质的量的相关计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:(1)1mol物质微粒含有的微粒个数为1NA,H2SO4为强电解质,完全电离,电离出的SO42-的物质的量就等于H2SO4的物质的量;
(2)根据H2O中氧原子百分含量为
×100%,CO2中氧原子百分含量为
×100%;
(3)根据n=
计算出71gNa2SO4的物质的量,在Na2SO4中Na+的物质的量是Na2SO4物质的量的2倍;
(2)根据H2O中氧原子百分含量为
| 16 |
| 1×2+16 |
| 16×2 |
| 12+16×2 |
(3)根据n=
| m |
| M |
解答:
解:(1)0.1摩H2SO4含有个0.2摩H原子,即0.2NA,H2SO4为强电解质,完全电离,电离出的SO42-的物质的量就等于H2SO4的物质的量,即为0.1mol,
故答案为:0.2NA;0.1;
(2)假设需要mgCO2,由题意可知:36×
×100%═m×
×100%,得出m=44,故答案为:44;
(3)根据n=
═
═0.5mol计算出71gNa2SO4的物质的量为0.5mol,所以Na+的物质的量为 1mol1,故答案为:1.
故答案为:0.2NA;0.1;
(2)假设需要mgCO2,由题意可知:36×
| 16 |
| 1×2+16 |
| 16×2 |
| 12+16×2 |
(3)根据n=
| m |
| M |
| 71g |
| 142g/mol |
点评:本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意相关概念和计算公式的运用,难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
下列各组离子在水溶液中不能发生反应的是( )
| A、Ag+、Cl- |
| B、H+、OH- |
| C、Na+、Cl- |
| D、Ba2+、SO42- |
NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L | ||||
| B、0.1mol?L-1的NaHSO4溶液中含有阳离子的物质的量为0.2mol | ||||
C、l.8g
| ||||
| D、7.8 gNa2S和7.8 gNa2O2中含有的阴离子数目均为0.1 NA |
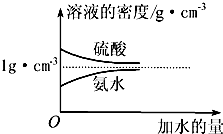 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题: (1)人类的生活和生产活动,可以说都离不开能源.在 ①石油、②电能、③风能、④煤、⑤天然气、⑥秸杆、⑦水力、⑧水煤气这些能源中,属于“二级能源”的是
(1)人类的生活和生产活动,可以说都离不开能源.在 ①石油、②电能、③风能、④煤、⑤天然气、⑥秸杆、⑦水力、⑧水煤气这些能源中,属于“二级能源”的是