题目内容
 按要求完成下列各小题.
按要求完成下列各小题.(1)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ?mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
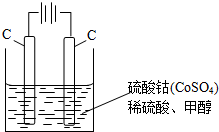
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:
①写出阳极电极反应式:
②写出除去甲醇的离子方程式:
考点:化学平衡的影响因素,化学电源新型电池
专题:化学平衡专题,电化学专题
分析:(1)焓变△H=反应物总键能-生成物总键能;
平衡常数指一定温度下,可逆反应到达平衡时,生成物浓度化学计量数次数幂之积与生成物浓度化学计量数次数幂之积的比值;
根据焓变判断升高温度平衡移动方向,进而判断平衡常数变化;根据反应前后气体的计量数判断熵变;
(2)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
平衡常数指一定温度下,可逆反应到达平衡时,生成物浓度化学计量数次数幂之积与生成物浓度化学计量数次数幂之积的比值;
根据焓变判断升高温度平衡移动方向,进而判断平衡常数变化;根据反应前后气体的计量数判断熵变;
(2)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
解答:
解:(1)焓变△H=反应物总键能-生成物总键能,故焓变△H=2×750kJ/mol+3×436kJ/mol-3×413kJ/mol-358kJ/mol-463kJ/mol-2×463kJ/mol=-178kJ/mol;
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数表达式k=
;
正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,该反应为气体体积减小的反应,所以熵也减小,所以△S<0,根据△G=△H-T△S
可知,该反应在低温下有利于自发进行,
故答案为:-178kJ/mol;
;减小;<;较低;
(2)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
故答案为:Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数表达式k=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,该反应为气体体积减小的反应,所以熵也减小,所以△S<0,根据△G=△H-T△S
可知,该反应在低温下有利于自发进行,
故答案为:-178kJ/mol;
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
(2)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
故答案为:Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
点评:本题综合性较强,涉及平衡常数、反应热计算、电化学知识等,属于拼合型题目,对学生的心理有较高的要求,难度中等.

练习册系列答案
相关题目
某些稠环环芳烃的结构简式如图: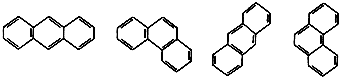 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A、这些结构简式表示的化合物有3种 |
| B、它们的分子式不相同 |
| C、所有原子均在同一平面 |
| D、它们与苯互为同系物 |
 ;⑦葡萄糖和果糖; ⑧金刚石与石墨.
;⑦葡萄糖和果糖; ⑧金刚石与石墨.