题目内容
下列物质中,物质的量最大的是 ,含分子个数最多的是 ,含原子个数最多的是 ,质量最大的是 .
A.6g H2; B.0.5mol CO2; C.1.20×1024个HCl分子; D.148g H2SO4.
A.6g H2; B.0.5mol CO2; C.1.20×1024个HCl分子; D.148g H2SO4.
考点:物质的量的相关计算
专题:计算题
分析:根据公式m=nM,N=nNA将选项中的各个物质的进行互转化然后进行计算比较即可.
解答:
解:A、6g H2的物质的量是
=3mol,含有的原子数是6NA,含有的分子数是3NA;
B、0.5mol CO2的质量是0.5mol×44g/mol=22g/mol,含有的原子数是1.5NA,含有的分子数是0.5NA;
C、1.20×1024个HCl分子的物质的量是
=2mol,含有的原子数是2NA,含有的分子数是2NA,质量是2mol×36.5g/mol=73g;
D、148g硫酸的物质的量是
=1.5mol,含有的原子数是10.5NA,含有的分子数是1.5NA;
物质的量最大的是A,含分子个数最多的是A,含原子个数最多的是D,质量最大的是C.
故答案为:A;A;D;C.
| 6g |
| 2g/mol |
B、0.5mol CO2的质量是0.5mol×44g/mol=22g/mol,含有的原子数是1.5NA,含有的分子数是0.5NA;
C、1.20×1024个HCl分子的物质的量是
| 1.20×1024 |
| 6.02×1023 |
D、148g硫酸的物质的量是
| 148g |
| 98g/mol |
物质的量最大的是A,含分子个数最多的是A,含原子个数最多的是D,质量最大的是C.
故答案为:A;A;D;C.
点评:本题考查学生公式m=nM,N=nNA的应用知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B、含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:OH-(aq)+H+(aq)═H2O(l) H=-a kJ?mol-1 |
| C、电解精炼铜时,电解初同一时间内,阳极溶解铜的质量比阴极析出铜的质量小 |
| D、对于2HI(g)?H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释 |
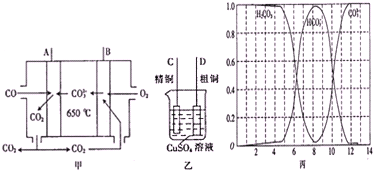
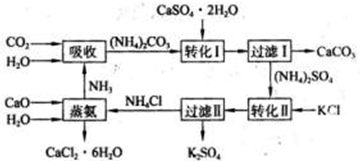
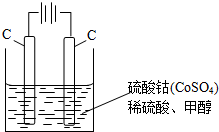 按要求完成下列各小题.
按要求完成下列各小题.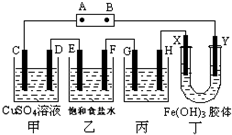 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题: