题目内容
12.为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查).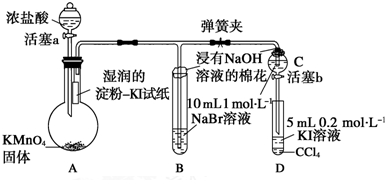
已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.…
(1)验证氯气的氧化性强于碘的实验现象是KI淀粉试纸变蓝.
(2)B中溶液发生反应的离子方程式是Cl2+2Br-=Br2+2Cl-.
(3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡.静置后CCl4层溶液变为紫红色.
(4)过程Ⅲ实验的目的是确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰.
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐增大(或电子层数逐渐增加),得电子能力逐渐减弱.
分析 装置A中是高锰酸钾固体和滴入的盐酸反应生成氯气,氯气和KI反应生成I2,I2单质遇到淀粉变蓝色,生成的氯气通入装置B中和NaBr反应生成溴单质,证明氯气氧化性大于溴,通过装置C排除Cl2对溴置换碘实验的干扰,溴单质和碘化钾反应生成碘单质,在四氯化碳中呈紫红色,证明溴单质氧化碘单质,
(1)根据氧化剂的氧化性大于氧化产物的氧化性,并检验产物碘;
(2)B中氯气与溴离子发生氧化还原反应生成溴单质和氯离子;
(3)根据氧化剂的氧化性大于氧化产物的氧化性,并检验产物碘的存在;
(4)为验证溴的氧化性强于碘,实验时应避免氯气的干扰;
(5)从原子结构(电子层数、原子半径)的角度分析.
解答 解:(1)因Cl2的氧化性大于I2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,可发生:Cl2+2I-=I2+2Cl-,I2能使淀粉变蓝,
故答案为:淀粉KI试纸变蓝;
(2)因Cl2的氧化性大于Br2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,可发生:Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-;
(3)因Cl2的氧化性大于I2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,会发生反应:Br2+2I-=I2+2Br-,同时检验产物碘的存在,所以为验证溴的氧化性强于碘,过程Ⅳ的操作和现象为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡.静置后CCl4层溶液变为紫红色,
故答案为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡.静置后CCl4层溶液变为紫红色;
(4)为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,
故答案为:确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰;
(5)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强,原子核对最外层电子的引力逐渐减弱,
故答案为:原子半径逐渐增大(或电子层数逐渐增加).
点评 本题主要考查了卤素单质间的置换反应,题目难度中等,注意掌握卤素单质的性质及递变规律,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力和化学实验能力.

| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、Cl-、SO42- | ||
| C. | NO3-、K+、Cl-、Na+ | D. | K+、Cl-、Al3+、SO42- |
| A. | 氧化还原反应的本质是有化合价的升降 | |
| B. | 据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| C. | 向醋酸溶液中加入少量氢氧化钠溶液,由于发生中和反应,溶液的导电能力降低 | |
| D. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第二位 |
| A. | 明矾用作净水剂 | B. | 生石灰作干燥剂 | ||
| C. | 过氧化氢溶液作消毒水 | D. | 液氨用作制冷剂 |
| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
(2)写出元素C的离子结构示意图
 .
.(3)D、E、F的简单离子半径由大到小的顺序是S2->Cl->Al3+.
(4)B与C形成的化合物,既含有离子键又含有非极性键,该化合物的电子式为
 .
.(5)A、C、E三种元素形成的具有漂白性的化合物,该化合物的结构式为H-O-Cl.
(6)D与E形成的化合物的类别是共价化合物(填共价化合物或离子化合物).
(7)能证明C的非金属性比F强的实验事实是水比硫化氢稳定.



 +CH2=CH2$\stackrel{催化剂}{→}$
+CH2=CH2$\stackrel{催化剂}{→}$ .
. +4Br2$\stackrel{催化剂}{→}$
+4Br2$\stackrel{催化剂}{→}$  +4HBr.
+4HBr. 、
、 、
、 等(仅写3种).
等(仅写3种).