题目内容
15.如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题.
(1)由②和④组成,造成温室效应的气体的结构式是O═C═O
(2)①、④、⑤、⑧中的某些元素可形成多种既含离子键又含共价键的化合物,写出其中一种化合物的电子式:.
(3)④、⑤、⑥的原子半径由大到小的顺序为(填元素符号).
(4)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式).
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.
分析 根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧分别是H、C、N、O、Na、Al、Si、Cl元素,
(1)由②和④组成,造成温室效应的气体为二氧化碳;
(2)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物有氢氧化钠、过氧化钠;
(3)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
(4)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(5)⑥的单质是铝,⑤的最高价氧化物的水化物是NaOH,它们发生反应生成偏铝酸钠和氢气.
解答 解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧分别是H、C、N、O、Na、Al、Si、Cl元素,
(1)由②和④组成,造成温室效应的气体为二氧化碳,结构式为O═C═O,
故答案为:O═C═O;
(2)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物有氢氧化钠,其电子式为 ,
,
故答案为: ;
;
(3)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径大小顺序是Na>Al>O,
故答案为:Na>Al>O;
(4)元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性N>C>Si,所以其最高价氧化物的水化物酸性HNO3>H2CO3>H2SiO3,
故答案为:HNO3>H2CO3>H2SiO3;
(5)⑥的单质是铝,⑤的最高价氧化物的水化物是NaOH,它们发生反应生成偏铝酸钠和氢气,离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑.
点评 本题考查位置、结构性质的综合应用,为高频考点,根据元素在周期表中的物质可推断出元素的种类,题中侧重于周期律的应用,学习中注意积累相关知识,把握电子式、反应方程式、离子反应等化学用语的书写,题目难度不大.

| A. | 炒菜时放入食盐并不破坏NaCl中的化学键 | |
| B. | HCl的电子式是H+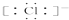 | |
| C. | HCl的结构式是H-Cl | |
| D. | NaCl熔化时破坏共价键 |
| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 蛋白质遇重金属离子会变性 | |
| C. | α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,只生成2种二肽 | |
| D. | 食用油反复加热会产生稠环芳香烃等有害物质 |
 ,下列有关M性质的叙述中错误的是( )
,下列有关M性质的叙述中错误的是( )| A. | M与金属钠完全反应时,二者物质的量之比为1:2 | |
| B. | M与碳酸氢钠完全反应时,二者物质的量之比为1:1 | |
| C. | M与氢氧化钠完全反应时,二者物质的量之比为1:2 | |
| D. | M既能与乙酸反应,又能与乙醇反应 |
| A. | 标准状况下,2.24L苯中含有碳碳双键的数目为0.3NA | |
| B. | 标准状况下,22.4LC12与某物质充分反应,一定转移NA个电子 | |
| C. | 1L0.1mol•L-1的HF溶液中含有的分子数一定大于0.1NA | |
| D. | 含有10.7gFe(OH)3的氢氧化铁胶体中胶粒总数为0.1NA |
| A. | CaCl2 | B. | Na2O2 | C. | NaOH | D. | K2S |
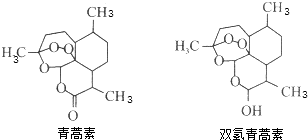
| A. | 青蒿素的分子式为C15H20O5 | |
| B. | 1 mol青蒿素最多能和1 molBr2发生加成反应 | |
| C. | 双氢青蒿素能发生氧化反应、酯化反应 | |
| D. | 青蒿素转化为双氢青蒿素发生了氧化反应 |
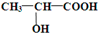
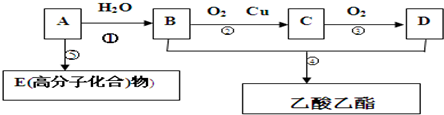
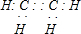
 CH3COOC2H5+H2O
CH3COOC2H5+H2O