题目内容
在20℃时,将5.05g KNO3溶于10.0g水中,恰好配成密度为1.15g/cm3的饱和溶液,计算:
(1)此饱和溶液中KNO3的物质的量.
(2)此饱和溶液中K+的物质的量浓度.
(1)此饱和溶液中KNO3的物质的量.
(2)此饱和溶液中K+的物质的量浓度.
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:(1)根据n=
计算KNO3的物质的量;
(2)计算溶液总质量,根据V=
计算溶液的体积,再根据c=
计算物质的量浓度.
| m |
| M |
(2)计算溶液总质量,根据V=
| m |
| ρ |
| n |
| V |
解答:
解:(1)n(KNO3)=
=0.05mol,
答:此饱和溶液中KNO3的物质的量为0.05mol;
(2)V(KNO3溶液)=
=0.0131L,
c(KNO3)=
=3.82mol/L,
答:此饱和溶液中KNO3的物质的量浓度为3.82mol/L.
| 5.05g |
| 101g/mol |
答:此饱和溶液中KNO3的物质的量为0.05mol;
(2)V(KNO3溶液)=
| 5.05g+10.0g |
| 1150g/L |
c(KNO3)=
| 0.05mol |
| 0.0131L |
答:此饱和溶液中KNO3的物质的量浓度为3.82mol/L.
点评:本题考查物质的量以及溶液浓度的计算,关键是对计算公式理解,难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、标准状况下,NA个分子所占的体积约为22.4 L |
| B、标准状况下,2.24L CH4和NH3混合气体中含有的电子数目为NA |
| C、0.1 mol?L-1的K2SO4溶液中阴、阳离子总数为0.3NA |
| D、标准状况下,22.4L氢气和氦气混合气体中含有的原子总数为2NA |

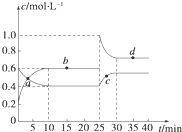 在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4(g)??2NO2(g)△H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示.
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4(g)??2NO2(g)△H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示.