题目内容
NA代表阿伏加德罗常数.下列说法中,正确的是( )
| A、标准状况下,2.24LSO3中含有氧原子数目为0.3NA |
| B、0.1 molCl2全部溶于水后转移电子数目为0.1 NA |
| C、只有在标准状况下,NA个 O2所占的体积才是22.4L |
| D、6.0g甲酸甲酯和正丙醇的混合物中含甲基数目为0.1 NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.标准状况下,三氧化硫的状态不是气体,不能使用气体摩尔体积计算其物质的量;
B.氯气溶于水,只有部分氯气与水反应生成氯化氢和次氯酸;
C.温度和压强都影响气体的体积,适当改变温度和压强后,1mol气体的体积也可以为22.4L;
D.苯甲酸和正丙醇中分子中都含有1个甲基,其摩尔质量都是60g/mol.
B.氯气溶于水,只有部分氯气与水反应生成氯化氢和次氯酸;
C.温度和压强都影响气体的体积,适当改变温度和压强后,1mol气体的体积也可以为22.4L;
D.苯甲酸和正丙醇中分子中都含有1个甲基,其摩尔质量都是60g/mol.
解答:
解:A.标况下三氧化硫不是气体,不能使用标况下的气体摩尔体积计算2.24L三氧化硫的物质的量,故A错误;
B.0.1mol氯气溶于水,由于只有部分氯气与水反应,则转移的电子小于0.1mol,转移电子数目小于0.1 NA,故B错误;
C.NA个O2的物质的量为1mol,标况下1mol气体体积为22.4L,但是如果适当改变温度和压强,不是在标况下1mol气体的体积也可以为22.4L,故C错误;
D.6.0g甲酸甲酯和正丙醇的物质的量为0.1mol,由于甲酸甲酯和正丙醇中都含有1个甲基,所以0.1mol混合物中含有0.1mol甲基,含甲基数目为0.1 NA,故D正确;
故选D.
B.0.1mol氯气溶于水,由于只有部分氯气与水反应,则转移的电子小于0.1mol,转移电子数目小于0.1 NA,故B错误;
C.NA个O2的物质的量为1mol,标况下1mol气体体积为22.4L,但是如果适当改变温度和压强,不是在标况下1mol气体的体积也可以为22.4L,故C错误;
D.6.0g甲酸甲酯和正丙醇的物质的量为0.1mol,由于甲酸甲酯和正丙醇中都含有1个甲基,所以0.1mol混合物中含有0.1mol甲基,含甲基数目为0.1 NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,选项B为易错点,注意氯气与水的反应情况.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式不正确的是( )
| A、澄清石灰水与过量苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | ||||
B、用惰性电极电解NaHS溶液:HS-+H2O
| ||||
| C、向摩尔盐溶液中加入过量的Ba(OH)2溶液:2NH4++Fe2++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)2↓+2NH3.H2O | ||||
| D、明矾溶液中加入Ba(OH)2溶液至生成的沉淀质量最多:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
下列所涉内容中,前者包含后者的是( )
| A、混合物 溶液 |
| B、电解质 化合物 |
| C、浊液 胶体 |
| D、化合反应 氧化还原反应 |
已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,下列叙述正确的是( )
| A、饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| B、向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 |
| C、向0.0008 mol?L-1的K2CrO4溶液中加入等体积的0.002mol/LAgNO3溶液,则CrO42-完全沉淀 |
| D、将0.001 mol?L-1的AgNO3溶液滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4溶液,则先产生AgCl沉淀 |
在1200℃时,天然气脱硫工艺中会发生下列反应 H2S(g)+
O2(g)=SO2(g)+H2O(g)△H1 2H2S(g)+SO2(g)=
S2(g)+2H2O(g)△H2 H2S(g)+
O2(g)=S(g)+H2O(g)△H3 2S(g)=S2(g)△H4则△H4的正确表达式为( )
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
A、△H4=
| ||
B、△H4=
| ||
C、△H4=
| ||
D、△H4=
|
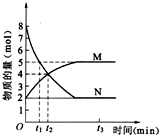 化学反应速率与化学平衡的理论研究对工农业生产有重要的意义.一定温度下,在容积为20L的密闭容器中进行a N(g)?b M(g) 的化学反应,M、N 的物质的量随时间的变化曲线如图所示:
化学反应速率与化学平衡的理论研究对工农业生产有重要的意义.一定温度下,在容积为20L的密闭容器中进行a N(g)?b M(g) 的化学反应,M、N 的物质的量随时间的变化曲线如图所示:
 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)