题目内容
16.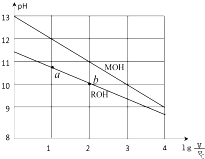 室温下,将浓度均为0.10mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述错误的是( )
室温下,将浓度均为0.10mol/L体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述错误的是( )①ROH的电离程度:b点大于a点
②MOH的碱性强于ROH的碱性
③当ROH溶液由a点到b点时,$\frac{{c({R^-})}}{{c(ROH)c({H^+})}}$变大
④若两溶液无限稀释,则它们的c(OH-)相等
⑤当$lg\frac{V}{V_0}=2$时,若两溶液同时升高温度,则 $\frac{{c({M^+})}}{{c({R^+})}}$增大.
| A. | ③⑤ | B. | ①⑤ | C. | ①③ | D. | ②④ |
分析 ①弱电解质在水溶液中随着浓度的减小其电离程度增大;
②浓度均为0.10mol/L,MOH的pH=13,为强碱;
③当ROH溶液由a点到b点时,ROH溶液的浓度减小,$\frac{{c({R^-})}}{{c(ROH)c({H^+})}}$=$\frac{c({R}^{-})c({H}^{+})}{c(ROH)}×\frac{1}{{c}^{2}({H}^{+})}$,据此分析;
④若两种溶液无限稀释,最终其溶液中c(OH-)接近于纯水中c(OH-);
⑤MOH的碱性强于ROH的碱性,当$lg\frac{V}{V_0}=2$时,若两溶液同时升高温度,促进弱电解质电离.
解答 解:①由图示可以看出ROH为弱碱,弱电解质在水溶液中随着浓度的减小其电离程度增大,b点溶液体积大于a点,所以b点浓度小于a点,则ROH电离程度:b>a,故正确;
②浓度均为0.10mol/L,MOH的pH=13,为强碱,ROH中氢氧根离子浓度小于碱的浓度,所以ROH为弱碱,则MOH的碱性强于ROH的碱性,正确;
③当ROH溶液由a点到b点时,ROH溶液的浓度减小,$\frac{{c({R^-})}}{{c(ROH)c({H^+})}}$=$\frac{c({R}^{-})c({H}^{+})}{c(ROH)}×\frac{1}{{c}^{2}({H}^{+})}$,加水稀释,c(OH-)减小,c(H+)增大,所以$\frac{{c({R^-})}}{{c(ROH)c({H^+})}}$减小,故错误;
④若两种溶液无限稀释,最终其溶液中c(OH-)接近于纯水中c(OH-),所以它们的c(OH-)相等,故正确;
⑤MOH的碱性强于ROH的碱性,当$lg\frac{V}{V_0}=2$时,若两溶液同时升高温度,促进弱电解质电离,c(R+)增大,c(M+)不变,所以 $\frac{{c({M^+})}}{{c({R^+})}}$增大,故正确.
故选A.
点评 本题考查弱电解质在水溶液中电离平衡,题目难度中等,明确弱电解质电离特点、弱电解质电离程度与溶液浓度关系等知识点是解本题关键,侧重于考查学生的分析能力.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案| A. | 常温下,向醋酸溶液中加入少量的水,溶液中c(H+)将增大 | |
| B. | 常温下,2NO(g)+2CO(g)═N2(g)+2CO2(g)能自发进行,则该反应的△H<0 | |
| C. | 因NaCl溶液和CH3COONH4溶液均显中性,故两溶液中水的电离程度相同 | |
| D. | 用CH3COOH溶液做导电实验,灯泡很暗,一定能证明CH3COOH是弱电解质 |
| 加入 试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验 现象 | 红色固体和 蓝色溶液 | 无色气体 | 无色气体和 蓝色溶液 | 红棕色气体 和蓝色溶液 |
| A. | Cu | B. | Cu2O | ||
| C. | 一定有Cu2O,可能有Cu | D. | 一定有Cu,可能有Cu2O |
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类数相同 | |
| B. | 乙烷、苯、裂化汽油溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环已烷的密度都比水大 | |
| D. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 |
| A. | 分离酒精和CCl4的混合物,可用分液法 | |
| B. | 从Na2CO3溶液中得到Na2CO3晶体,可用过滤法 | |
| C. | 从I2的CCl4溶液中得到CCl4,可用蒸馏法 | |
| D. | 分离NaCl和AgCl的混合物,可用萃取法 |
| A. | CO2 | B. | KOH | C. | Cu | D. | NaCl溶液 |
| A. | NaBH4既是氧化剂又是还原剂 | |
| B. | NaBH4是氧化剂,H2O是还原剂 | |
| C. | 等物质的量的NaBH4、Na分别与足量水反应,NaBH4生成的氧化产物比Na少 | |
| D. | 被氧化的元素与被还原的元素质量比为1:1 |
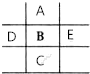 如图是元素周期表的一部分,已知A、B、C、D、E5种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是( )
如图是元素周期表的一部分,已知A、B、C、D、E5种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是( )