题目内容
某相对分子质量为26的烃A,是一种重要的有机化工原料,以A为原料在不同的反应条件下可以转化为烃B、烃C.B和C分子的核磁共振氢谱中都只有一个吸收峰.以C为原料通过下列方案可以制备具有光谱高效食品防腐作用的有机物M,M分子的球棍模型如图所示.

(1)A的结构简式为 ,B能使溴的四氯化碳溶液褪色,则B的结构简式为 ,1mol B与等物质的量的Br2作用时可能有 种产物.
(2)C→D的反应类型为 ,M的分子式为 .
(3)写出E→F的化学方程式 .
(4)G中的含氧官能团的名称是 ,写出由G反应生成高分子的化学反应方程式 .
(5)M的同分异构体有多种,写出两种满足以下条件的同分异构体的结构简式:
①能发生银镜反应
②含有苯环,苯环上有两个侧链且苯环上一氯取代物有两种
③遇FeCl3溶液不显紫色
④1mol该有机物与足量的钠反应生成1mol氢气(一个碳原子上不同时连接两个-OH) .

(1)A的结构简式为
(2)C→D的反应类型为
(3)写出E→F的化学方程式
(4)G中的含氧官能团的名称是
(5)M的同分异构体有多种,写出两种满足以下条件的同分异构体的结构简式:
①能发生银镜反应
②含有苯环,苯环上有两个侧链且苯环上一氯取代物有两种
③遇FeCl3溶液不显紫色
④1mol该有机物与足量的钠反应生成1mol氢气(一个碳原子上不同时连接两个-OH)
考点:有机物的推断
专题:有机物的化学性质及推断
分析:某相对分子质量为26的烃A,则A是HC≡CH,以A为原料在不同的反应条件下可以转化为烃B、烃C,B分子式为C8H8,C的相对分子质量为78,则C分子中碳原子最大数目为
=6…6,则C分子式为C6H6,B和C分子的核磁共振氢谱中都有一个吸收峰,说明B和C都只有一种类型的氢原子,B能使溴的四氯化碳溶液褪色,B含有不饱和键,则B为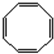 ,由D的取代产物结构,结合转化关系可知C为
,由D的取代产物结构,结合转化关系可知C为 ,苯和丙烯发生加成反应生成D,D和氯气发生取代反应生成
,苯和丙烯发生加成反应生成D,D和氯气发生取代反应生成 ,则D的结构简式为:
,则D的结构简式为: ,
, 被酸性高锰酸钾氧化生成E,则E是
被酸性高锰酸钾氧化生成E,则E是 ,E和氢氧化钠的水溶液发生取代反应生成F,F酸化得到G,G与醇得到得到M,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,其分子式为:C9H10O3.则G是
,E和氢氧化钠的水溶液发生取代反应生成F,F酸化得到G,G与醇得到得到M,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,其分子式为:C9H10O3.则G是 ,故F的结构简式为:
,故F的结构简式为: ,据此解答.
,据此解答.
| 78 |
| 12 |
 ,由D的取代产物结构,结合转化关系可知C为
,由D的取代产物结构,结合转化关系可知C为 ,苯和丙烯发生加成反应生成D,D和氯气发生取代反应生成
,苯和丙烯发生加成反应生成D,D和氯气发生取代反应生成 ,则D的结构简式为:
,则D的结构简式为: ,
, 被酸性高锰酸钾氧化生成E,则E是
被酸性高锰酸钾氧化生成E,则E是 ,E和氢氧化钠的水溶液发生取代反应生成F,F酸化得到G,G与醇得到得到M,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,其分子式为:C9H10O3.则G是
,E和氢氧化钠的水溶液发生取代反应生成F,F酸化得到G,G与醇得到得到M,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,其分子式为:C9H10O3.则G是 ,故F的结构简式为:
,故F的结构简式为: ,据此解答.
,据此解答.解答:
解:某相对分子质量为26的烃A,则A是HC≡CH,以A为原料在不同的反应条件下可以转化为烃B、烃C,B分子式为C8H8,C的相对分子质量为78,则C分子中碳原子最大数目为
=6…6,则C分子式为C6H6,B和C分子的核磁共振氢谱中都有一个吸收峰,说明B和C都只有一种类型的氢原子,B能使溴的四氯化碳溶液褪色,B含有不饱和键,则B为 ,由D的取代产物结构,结合转化关系可知C为
,由D的取代产物结构,结合转化关系可知C为 ,苯和丙烯发生加成反应生成D,D和氯气发生取代反应生成
,苯和丙烯发生加成反应生成D,D和氯气发生取代反应生成 ,则D的结构简式为:
,则D的结构简式为: ,
, 被酸性高锰酸钾氧化生成E,则E是
被酸性高锰酸钾氧化生成E,则E是 ,E和氢氧化钠的水溶液发生取代反应生成F,F酸化得到G,G与醇得到得到M,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,其分子式为:C9H10O3.则G是
,E和氢氧化钠的水溶液发生取代反应生成F,F酸化得到G,G与醇得到得到M,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,其分子式为:C9H10O3.则G是 ,故F的结构简式为:
,故F的结构简式为: ,
,
(1)由上述分析可知,A为HC≡CH,B为 ,1molB与等物质的量的Br2作用时可能有1,2-加成或1,4-加成,所以可能有2种结构,
,1molB与等物质的量的Br2作用时可能有1,2-加成或1,4-加成,所以可能有2种结构,
故答案为:HC≡CH; ;2;
;2;
(2)C→D是 与丙烯发生加成反应生成
与丙烯发生加成反应生成 ,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,所以其分子式为:C9H10O3,故答案为:加成反应;C9H10O3;
,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,所以其分子式为:C9H10O3,故答案为:加成反应;C9H10O3;
(3)E→F转化的化学反应方程式为: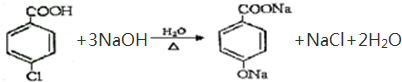 ,
,
故答案为: ;
;
(4)G为 ,含有的官能团为:羟基、羧基;
,含有的官能团为:羟基、羧基;
G反应生成高分子的化学反应方程式为: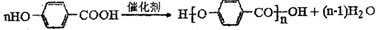 ,
,
故答案为:羟基、羧基;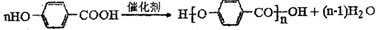 ;
;
(5)M是对羟基苯甲酸乙酯,M的同分异构体有多种,符合下列条件:
①能发生银镜反应,说明含有醛基;
②含有苯环,苯环上有两个侧链且苯环上一氯取代物有两种,说明苯环上两个支链处于对位;
③遇FeCl3溶液不显紫色,说明不含酚羟基;
④1mol该有机物与足量的钠反应生成1mol氢气(一个碳原子上不同时连接两个-OH),说明含有两个醇羟基和一个醛基,则符合条件的M的同分异构体有: 等,
等,
故答案为: .
.
| 78 |
| 12 |
 ,由D的取代产物结构,结合转化关系可知C为
,由D的取代产物结构,结合转化关系可知C为 ,苯和丙烯发生加成反应生成D,D和氯气发生取代反应生成
,苯和丙烯发生加成反应生成D,D和氯气发生取代反应生成 ,则D的结构简式为:
,则D的结构简式为: ,
, 被酸性高锰酸钾氧化生成E,则E是
被酸性高锰酸钾氧化生成E,则E是 ,E和氢氧化钠的水溶液发生取代反应生成F,F酸化得到G,G与醇得到得到M,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,其分子式为:C9H10O3.则G是
,E和氢氧化钠的水溶液发生取代反应生成F,F酸化得到G,G与醇得到得到M,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,其分子式为:C9H10O3.则G是 ,故F的结构简式为:
,故F的结构简式为: ,
,(1)由上述分析可知,A为HC≡CH,B为
 ,1molB与等物质的量的Br2作用时可能有1,2-加成或1,4-加成,所以可能有2种结构,
,1molB与等物质的量的Br2作用时可能有1,2-加成或1,4-加成,所以可能有2种结构,故答案为:HC≡CH;
 ;2;
;2;(2)C→D是
 与丙烯发生加成反应生成
与丙烯发生加成反应生成 ,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,所以其分子式为:C9H10O3,故答案为:加成反应;C9H10O3;
,根据M分子的球棍模型知,M是对羟基苯甲酸乙酯,所以其分子式为:C9H10O3,故答案为:加成反应;C9H10O3;(3)E→F转化的化学反应方程式为:
 ,
,故答案为:
 ;
;(4)G为
 ,含有的官能团为:羟基、羧基;
,含有的官能团为:羟基、羧基;G反应生成高分子的化学反应方程式为:
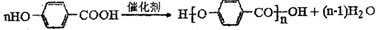 ,
,故答案为:羟基、羧基;
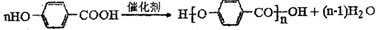 ;
;(5)M是对羟基苯甲酸乙酯,M的同分异构体有多种,符合下列条件:
①能发生银镜反应,说明含有醛基;
②含有苯环,苯环上有两个侧链且苯环上一氯取代物有两种,说明苯环上两个支链处于对位;
③遇FeCl3溶液不显紫色,说明不含酚羟基;
④1mol该有机物与足量的钠反应生成1mol氢气(一个碳原子上不同时连接两个-OH),说明含有两个醇羟基和一个醛基,则符合条件的M的同分异构体有:
 等,
等,故答案为:
 .
.
点评:本题考查有机物推断、官能团、有机反应类型、同分异构体的判断以及方程式的书写,是高考中的常见题型,属于中等难度的试题,综合性强,侧重对有机化学基础知识和逻辑思维能力考查,有利于培养学生的自学能力和知识的迁移能力,需要学生熟练掌握官能团的结构、性质及相互转化.

练习册系列答案
相关题目
常温下,将pH=3的盐酸与pH=9的Ba(OH)2溶液混合,若要得到pH=7的溶液,混合时盐酸与Ba(OH)2溶液的体积比为( )
| A、1:60 | B、3:1 |
| C、100:1 | D、1:100 |
下列为人体提供能量的营养物质中,属于高分子化合物的是( )
| A、蛋白质 | B、油脂 |
| C、葡萄糖 | D、蔗糖 |
 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.