题目内容
(1)家用液化石油气的主要成分之一是丁烷(C4H10),当10kg丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为5×105 kJ.试写出丁烷燃烧的热化学方程式: .
已知1mol液态水汽化时需要吸收44kJ热量,则1mol丁烷完全燃烧生成二氧化碳气体和气态水时,放出的热量为 kJ.
(2)有同学制作一氢氧燃烧电池,通入H2的一极为 极.若以稀硫酸为电解质溶液时,其正极反应式为 .
已知1mol液态水汽化时需要吸收44kJ热量,则1mol丁烷完全燃烧生成二氧化碳气体和气态水时,放出的热量为
(2)有同学制作一氢氧燃烧电池,通入H2的一极为
考点:有关反应热的计算,原电池和电解池的工作原理
专题:
分析:(1)依据质量换算物质的量,结合化学方程式对应的物质的量计算反应放出的热量,依据热化学方程式书写方法,标注物质聚集状态和反应焓变写出;已知1mol液态水汽化时需要吸收44kJ热量,依据热化学方程式和盖斯定律计算得到;
(2)燃料电池依据原电池原理可知燃料做负极失电子发生氧化反应,氧气在正极得到电子发生还原反应生成氢氧化根离子在酸溶液中生成水.
(2)燃料电池依据原电池原理可知燃料做负极失电子发生氧化反应,氧气在正极得到电子发生还原反应生成氢氧化根离子在酸溶液中生成水.
解答:
解:(1)当10kg丁烷完全反应物质的量
=
mol,完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,2mol丁烷完全反应放热=
=5800KJ,依据反应物和产物状态标注聚集状态和对应量下的反应热,书写的热化学方程式为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;
已知1mol液态水汽化时需要吸收44kJ热量,
①H2O(l)=H2O(g)△H=44kJ/mol;②2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;
依据盖斯定律①×10+②得到2C4H10(g)+13O2(g)=8CO2(g)+10H2O(g)△H=-5360kJ/mol;
C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(g)的△H=-2680KJ/mol;
故答案为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol,2680;
(2)燃料电池依据原电池原理可知,燃料氢气做负极失电子发生氧化反应,氧气在正极得到电子发生还原反应生成氢氧化根离子在酸溶液中生成水,正极电极反应为:O2+4e-+4H+=2H2O;
故答案为:负,O2+4e-+4H+=2H2O;
| 10000g |
| 58g/mol |
| 10000 |
| 58 |
| ||
| 58 |
已知1mol液态水汽化时需要吸收44kJ热量,
①H2O(l)=H2O(g)△H=44kJ/mol;②2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;
依据盖斯定律①×10+②得到2C4H10(g)+13O2(g)=8CO2(g)+10H2O(g)△H=-5360kJ/mol;
C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(g)的△H=-2680KJ/mol;
故答案为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol,2680;
(2)燃料电池依据原电池原理可知,燃料氢气做负极失电子发生氧化反应,氧气在正极得到电子发生还原反应生成氢氧化根离子在酸溶液中生成水,正极电极反应为:O2+4e-+4H+=2H2O;
故答案为:负,O2+4e-+4H+=2H2O;
点评:本题考查了热化学方程式的书写方法和计算应用,题目难度中等,注意焓变计算和物质聚集状态的标注,焓变与键能计算关系,掌握基础是关键.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列元素的原子序数为5的是( )
| A、H | B、Li | C、B | D、P |
反应C(s)+H2O(g)?CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A、在密闭容器中通入水蒸气 |
| B、升温 |
| C、保持体积不变,充入氦气使体系压强增大 |
| D、保持压强不变,充入氦气使容器体积增大 |
M的名称是乙烯雌酚,它是一种激素类药物,结构简式如图.下列叙述不正确的是( )
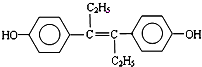

| A、M属于芳香族化合物 |
| B、M可与NaOH溶液或NaHCO3溶液发生反应 |
| C、1molM最多能与7molH2发生加成反应 |
| D、1molM与饱和溴水混合,最多消耗5molBr2 |
在强酸性溶液中,下列各组离子能够大量共存的是( )
| A、Mg2+、Ca2+、HCO3-、CI- |
| B、Na+、CO32-、Cl-、SO42- |
| C、K+、Fe2+、SO42-、Br- |
| D、Fe2+、Ca2+、Cl-、NO3- |
 等质量的两种活泼金属M和N,分别与足量的盐酸充分反应,生成H2的质量与反应时间关系如图所示.下列叙述中不正确 的是( )
等质量的两种活泼金属M和N,分别与足量的盐酸充分反应,生成H2的质量与反应时间关系如图所示.下列叙述中不正确 的是( )| A、失去的电子数:M>N |
| B、生成H2的反应速率:M>N |
| C、消耗HCl的物质的量:M>N |
| D、a、b两点时所消耗金属的质量:M>N |
