题目内容
下列关于0.1mol/L NaHCO3溶液的说法中正确的是( )
| A、常温下pH<7 |
| B、c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C、c(CO32-)+c(HCO3-)+c(H2CO3)=c(Na+) |
| D、c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
考点:离子浓度大小的比较,盐类水解的应用
专题:盐类的水解专题
分析:NaHCO3是强碱弱酸酸式盐,碳酸氢根离子水解程度大于电离程度,导致溶液呈碱性,溶液中存在电荷守恒和物料守恒,据此分析解答.
解答:
解:A.常温下,NaHCO3是强碱弱酸酸式盐,碳酸氢根离子水解程度大于电离程度,导致溶液呈碱性,则pH>7,故A错误;
B.溶液呈存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故B错误;
C.溶液中存在物料守恒,根据物料守恒得c(CO32-)+c(HCO3-)+c(H2CO3)=c(Na+),故C正确;
D.碳酸氢根离子水解程度大于电离程度,导致溶液呈碱性,所以c(CO32-)<c(H2CO3),故D错误;
故选C.
B.溶液呈存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故B错误;
C.溶液中存在物料守恒,根据物料守恒得c(CO32-)+c(HCO3-)+c(H2CO3)=c(Na+),故C正确;
D.碳酸氢根离子水解程度大于电离程度,导致溶液呈碱性,所以c(CO32-)<c(H2CO3),故D错误;
故选C.
点评:本题以盐类水解为载体考查了离子浓度大小比较,根据盐的特点及碳酸氢根离子水解程度与电离程度的相对大小确定溶液酸碱性,再结合守恒思想分析解答,题目难度中等.

练习册系列答案
相关题目
 2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.”已知结构如图所示,则下列说法正确的是( )
2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.”已知结构如图所示,则下列说法正确的是( )| A、青蒿素与维生素C一样易溶于水工作 |
| B、所有碳原子都可能在同一平面上 |
| C、青蒿素晶体为分子晶体,其化学式为C15H22O5,具有较强氧化性 |
| D、含有酯基,在胃酸作用下能水解,其水解产物能使氯化铁溶液显紫色 |
下列说法正确的是( )
| A、离子化合物中可能含有共价键,但不一定含有金属元素 |
| B、分子中一定含有共价键 |
| C、非极性分子中一定存在非极性键 |
| D、对于组成结构相似的分子,一定是相对分子质量越大,熔沸点越高 |
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是( )
| A、K值不变,平衡可能移动 |
| B、K值变化,平衡一定移动 |
| C、平衡移动,K值可能不变 |
| D、平衡移动,K值一定变化 |
下列物质的水溶液中,加入稀H2SO4或MgCl2都有白色沉淀生成的是( )
| A、BaCl2 |
| B、Na2CO3 |
| C、KOH |
| D、Ba(OH)2 |
关于小苏打水溶液的表述正确的是( )
| A、c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
| B、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| C、c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+) |
| D、c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
下列各组中的两种物质相互作用时,反应条件或反应物的用量改变,对生成物没有影响的是( )
| A、过氧化钠和二氧化碳 |
| B、钠和氧气 |
| C、氢氧化钠和二氧化碳 |
| D、碳和氧气 |
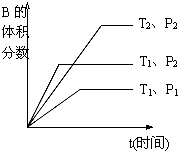 已知某可逆反应mA(g)+nB(g)?qC(g)+pD(s)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空(注:(2)、(3)、(4)题填“>”、“<”或“=”):
已知某可逆反应mA(g)+nB(g)?qC(g)+pD(s)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空(注:(2)、(3)、(4)题填“>”、“<”或“=”):