题目内容
19.某溶液中含有0.3mol NaNO3和0.5mol H2SO4,向该溶液中加入14.4g金属Mg,充分反应后产生NO气体(假定无其他还原产物),NO在标准状况下的体积为( )| A. | 8.96L | B. | 6.72L | C. | 5.6L | D. | 4.48L |
分析 该混合液中含有:n(H+)=0.5mol×2=1mol,n(NO3-)=0.3mol,首先发生反应:3Mg+2NO3-+8H+=3Mg2++2NO↑+4H2O,Mg的质量为14.4g,物质的量为:$\frac{14.4g}{24g/mol}$=0.6mol,由离子方程式可知,0.3mol硝酸根离子完全反应消耗1.2mol氢离子、0.9mol,显然氢离子不足,反应只生产NO气体,结合氢离子和镁离子的物质的量判断过量情况,然后根据不足量计算出生成NO气体的物质的量,最后根据V=nVm计算出生成NO的体积.
解答 解:混合液中含有:n(H+)=0.5mol×2=1mol,n(NO3-)=0.3mol,首先发生反应:3Mg+2NO3-+8H+=3Mg2++2NO↑+4H2O,Mg的质量为14.4g,物质的量为:$\frac{14.4g}{24g/mol}$=0.6mol,
3Mg+2NO3-+8H+=3Mg2++2NO↑+4H2O,
3 2 8 2
0.6mol n(NO3-)n(H+)
0.6molMg完全反应消耗硝酸根离子为:n(NO3-)=$\frac{0.6mol×2}{3}$=0.4mol,消耗氢离子为:n(H+)=$\frac{0.6mol×8}{3}$=1.6mol,
显然硝酸根离子、氢离子不足,且0.3mol硝酸根离子完全反应消耗氢离子的物质的量为:$\frac{0.3mol×8}{2}$=1.2mol>1mol,
所以反应中氢离子不足,只有NO气体生成,
1mol氢离子完全反应生成NO的物质的量为:n(NO)=$\frac{1mol×2}{8}$=0.25mol,
标准状况下0.25molNO的体积为:22.4L/mol×0.25mol=5.6L,
故选C.
点评 本题考查化学方程式的计算、反应物过量计算,题目难度中等,明确发生反应的实质为解答关键,注意根据反应方程式正确判断反应物过量情况的方法,试题培养了学生的化学计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | 2.1g | B. | 3.6g | C. | 5.7g | D. | 37.7g |
| A. | 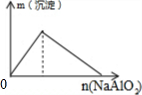 向盐酸中滴入NaAlO2溶液 | B. | 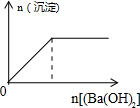 NaHSO4溶液中逐滴加入Ba(OH)2溶液 | ||
| C. | 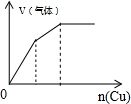 将铜粉加入到一定浓硝酸中 | D. | 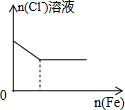 将铁粉加入到一定量氯化铁溶液中 |
| A. | NH3→NO→NO2→HNO3 | B. | Al→Al2O3→Al(OH)3→NaAlO2 | ||
| C. | S→SO2→H2SO4→MgSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
| A. | 乙酸的结构简式:C2H4O2 | |
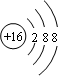
| B. | S2-的结构示意图: | |
| C. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | CO2的电子式${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
| Y | Z | ||
| X | W |
| A. | 原子半径:X>Z>Y | B. | 气态氢化物的稳定性:X>Z | ||
| C. | Z、W均可与Mg形成离子化合物 | D. | 氧化物对应水化物的酸性:W>Y |
 ,32g甲在足量浓硝酸中反应转移的电子数为2NA.
,32g甲在足量浓硝酸中反应转移的电子数为2NA.