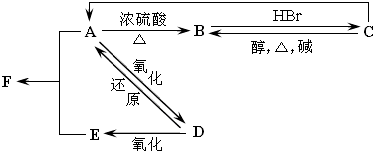
题目内容
16.a g铜、铁与一定量浓硝酸反应后,向所得到溶液中加入KSCN溶液无明显变化,将所得其体与1.68L O2(标准状况)混合后通入水中,所有气体能完全被水吸收生成硝酸.则a可能为( )| A. | 8.4 | B. | 9.6 | C. | 6 | D. | 9.2 |
分析 铜、铁先被硝酸氧化,向所得到溶液中加入KSCN溶液无明显变化,说明铁反应生成硝酸亚铁,然后生成气体又被O2氧化成硝酸,所以可以直接认为ag铜、铁失的电子被1.68LO2获得,由于没有生成三价铁,所以铜和铁都是失2个电子,据此可计算出混合金属的物质的量,然后利用极值法确定a的范围.
解答 解:铜、铁先被硝酸氧化,向所得到溶液中加入KSCN溶液无明显变化,说明铁反应生成硝酸亚铁,然后生成气体又被O2氧化成硝酸,所以可以直接认为ag铜、铁失的电子被1.68LO2获得,根据电子转移守恒,故金属失去的电子为:$\frac{1.68L}{22.4L/mol}$×4=0.3mol,
由于没有生成三价铁,所以铜和铁都是失2个电子,则Cu和Fe的总物质的量为:$\frac{0.3mol}{2}$=0.15mol,
当金属完全为Cu时,金属的质量为:64g/mol×0.15mol=9.6g,
当金属完全为Fe时,金属的质量为:56g/mol×0.15mol=8.4g,
所以混合金属的质量范围为:8.4g~9.6g,
满足条件的为D,
故选D.
点评 本题考查了氧化还原反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
6.球墨铸铁中含有一种铁碳化合物X.实验小组为测定化合物X的组成设计实验如下:

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 固体2是氧化铁 | |
| B. | X的化学式可以表示为Fe3C2 | |
| C. | 溶液甲加热、蒸发、灼烧也可得到24.0g固体 | |
| D. | X与足量的热浓硝酸反应有NO2和CO2生成 |
4.对于反应4NH3+5O2=4NO+6H2O,下列为四种不同情况下测得的反应速率(用v表示),其中能表明该反应进行最快的是( )
| A. | v (NH3)=0.2 mol/(L•s) | B. | v (O2)=1.4mol/(L•min) | ||
| C. | v (H2O)=0.25 mol/(L•s) | D. | v (NO)=9 mol/(L•min) |
11.某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )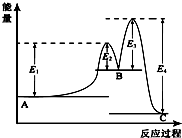

| A. | A?B的反应热△H=+(E2-E1)KJ/mol | |
| B. | 三种化合物中A最稳定 | |
| C. | C?B是放热反应 | |
| D. | 催化剂是要参与化学反应的,使用合适的催化剂可以降低反应所需要的活化能 |
1.卫生部发出公告,自2012年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂.下列对于过氧化钙(CaO2)的叙述错误的是( )
| A. | CaO2具有氧化性,对面粉可能具有增白作用 | |
| B. | CaO2与水反应时,每产生1molO2转移电子4mol | |
| C. | CaO2中阴阳离子的个数比为1:1 | |
| D. | CaO2与CO2反应的化学方程式为2CaO2+2CO2═2CaCO3+O2 |
5.下列说法中正确的是( )
| A. | NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28′ | |
| C. | NaCl晶体中与每个Na+距离相等且最近Na+共有12个 | |
| D. | CsCl晶体中与每个Cs+距离相等且最近Cl-共有6个 |
6.下列离子方程式书写正确的是( )
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 碳酸氢钠溶液中滴加氢氧化钠溶液:HCO3-+OH-═CO2+H2O | |
| D. | 过氧化钠与水的反应:2Na2O2+2H2O═4Na++4OH-+O2↑ |