题目内容
4.下列说法正确的是( )①太阳能电池可采用硅材料制作,其应用有利于环保、节能
②在酒精灯加热条件下,Na2CO3和NaHCO3固体都能发生分解
③H2S、SO2、CO2三种气体都可以用浓硫酸干燥
④SO2中混有的少量HCl气体可以用饱和亚硫酸氢钠溶液除去
⑤检验FeCl2溶液中的Fe2+,先加入氯水再滴加少量KSCN溶液,观察现象
⑥将AlCl3溶液在HCl气流中加热蒸干制得AlCl3固体,将固体熔融电解可制得金属铝
⑦用PH试纸测得某氯水的PH=4
⑧向硅酸钠溶液中滴加稀盐酸,生成白色沉淀,不能证明氯元素的非金属性强于硅元素
⑨水中的SO42-、Na+、K+、Cl-可用电渗析法除去
⑩煤经过气化和液化的物理变化可变为清洁燃料.
| A. | ③④⑦⑩ | B. | ①③⑥⑧ | C. | ①④⑧⑨ | D. | ②⑤⑦⑨ |
分析 ①太阳能电池的成分是硅单质;
②Na2CO3加热不分解;
③所干燥的物质不能与干燥剂发生反应;
④HCl可与亚硫酸氢钠反应生成二氧化硫气体;
⑤Fe2+的检验应先加少量KSCN溶液,再加氯水;
⑥氯化铝是共价合物,熔融态不导电;
⑦次氯酸具有漂白性;
⑧根据元素最高价氧化物对应水化物的酸性可以比较元素的非金属性强弱;
⑨可用电渗析法除去水中的SO42-、Na+、K+、Cl-等;
⑩没有新物质生成的变化是物理变化,有新物质生成的变化是化学变化.
解答 解:①太阳能电池的成分是硅单质,太阳能是清洁能源,故①正确;
②NaHCO3不稳定,加热易分解:2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O,Na2CO3加热不分解,故②错误;
③H2S与浓硫酸发生氧化还原反应,不能用浓硫酸干燥,故③错误;
④二氧化硫不与亚硫酸氢钠反应,HCl可与亚硫酸氢钠反应生成二氧化硫气体,从而将杂质气体除去,故④正确;
⑤先滴加氯水,亚铁离子被氧化生成铁离子,加KSCN溶液变血红色,只能说明加氯水后溶液中含三价铁离子,不能检验原溶液是否含亚铁离子;Fe2+的检验应先加少量KSCN溶液,无明显现象,再加氯水,溶液变血红色,说明原溶液中含亚铁离子,故⑤错误;
⑥HCl可抑制氯化铝的水解,则将AlCl3溶液在HCl气流中加热蒸干制得AlCl3固体,氯化铝在熔融态不导电,制金属铝是电解熔融氧化铝,故⑥错误;
⑦氯水中次氯酸具有漂白性,能漂白pH试纸,应该用pH计测定氯水pH值,故⑦错误;
⑧在硅酸钠溶液中滴入稀盐酸,溶液变浑浊,说明盐酸的酸性强于硅酸,但是不能说明Cl元素的非金属性强于Si元素,故⑧正确;
⑨电渗析法是一种利用离子交换膜进行离子交换的方法,可用电渗析法除去水中的SO42-、Na+、K+、Cl-等,故⑨正确;
⑩煤的气化是将其转化为可燃性气体的过程,属于化学变化;煤的液化是使煤与氢气作用生成液体燃料,属于化学变化,故⑩错误;
综上分析正确的有①④⑧⑨;
故选C.
点评 本题考查物质的性质及应用,把握物质的性质、性质与用途的关系为解答的关键,为高频考点,侧重于学生的实验分析能力和综合理解运用能力的考查,有利于培养学生的良好的科学素养,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 碘水 | B. | 氯化钠溶液 | C. | 氢氧化钠溶液 | D. | 溴水 |
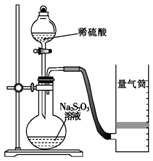 下面是某同学测定化学反应速率并探究其影响因素的实验.
下面是某同学测定化学反应速率并探究其影响因素的实验.Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率.
(已知:S2O32-+2H+=H2O+S↓+SO2↑)
(1)除如图所示的实验用品、仪器外,还需要的一件实验仪器是秒表.
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是SO2会部分溶于水,导致所测得SO2体积偏小.
(3)试简述测定该反应的化学反应速率的其他方法:测定一段时间内生成硫单质的质量或测定一定时间内溶液H+浓度的变化等(写一种).
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如表.(已知 I2+2S2O32-=S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
| A. | 按系统命名法,化合物 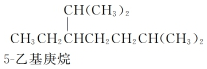 的名称为2,6二甲基5乙基庚烷 的名称为2,6二甲基5乙基庚烷 | |
| B. | 丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 | |
| C. | 化合物  是苯的同系物 是苯的同系物 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
| A. | 次氯酸分子的结构式: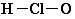 | |
| B. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| C. | NH4Cl的电子式: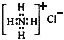 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |

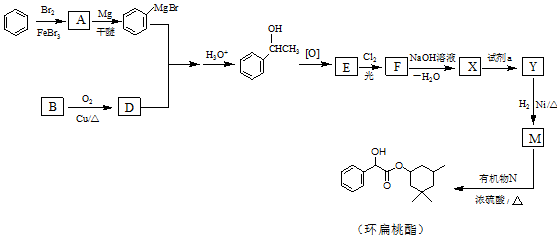
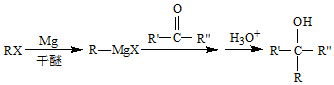 (R、R′、R″代表烃基或氢)
(R、R′、R″代表烃基或氢)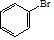 .
.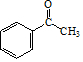 .
.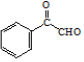 .
.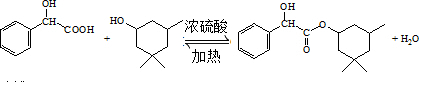 .
.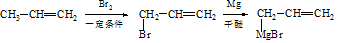
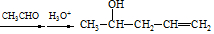
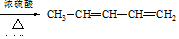 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).