题目内容
1.一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3)的原理如图1: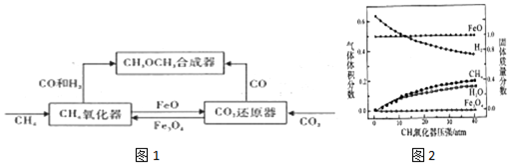
(1)二甲醚的合成反应:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H1
①已知CO、H2与CH3OCH的燃烧热(△H)分别为a kJ•mol-1、b kJ•mol-1、c kJ•mol-1、(a、b、c均小于0),则△H1=(3a+3b-c)kJ•mol-1.
②该反应选用CuO/ZnO/Al2O3复合催化剂,该催化剂能B、C(填标号).
A.促进平衡正向移动 B.提高反应速率
C.降低反应的活化能 D.改变反应的焓变
(2)CH4氧化器中发生的主反应:
ⅰ.CH4(g)+Fe3O4(s)?CO(g)+2H2(g)+3Fe(s)
ⅱ.CH4(g)+4Fe3O4(s)?CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如图2.
①随着压强的增大,反应ⅰ的平衡常数K值不变 (填“增大”、“减小”、或“不变”)
②结合图象,分析H2O的体积分数变化的原因Fe3O4+H2$\frac{\underline{\;高温\;}}{\;}$3FeO+H2O(用化学方程式表示)
(3)将一定量的FeO和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:
CO2(g)+3FeO(s)?Fe3O4(s)+CO (g)△H2
保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如表:
| 温度I/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
| CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
| CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
②若在150℃时进行上述转化,理论转化率ɑ(FeO)=100%.
③在上述反应体系中,一定可以说明该反应达到平衡状态的是B、C、D(填标号).
A.体系的压强不变 B.CO2的物质的量不变
C.CO的生成速率和消耗速率相等且不等于零 D.气体的平均摩尔质量不变
④根据化学反应原理,分析CO2还原器温度设置在170℃的原因温度过高,CO2的转化率低;温度过低,反应速率比较慢.
分析 (1)①根据CO、H2与CH3OCH的燃烧热写出三个热化学方程式,所求反应可以由这三个热化学方程式推导,根据盖斯定律计算所求反应的焓变;
②催化剂能降低反应的活化能,增大化学反应速率,但不改变化学的平衡,也不改变反应的焓变;
(2)①化学平衡常数K只随温度的改变而改变;
②根据图象分析,随着反应的进行,H2的含量降低,H2O的含量增大,可推断反应过程中H2转化为了H2O,发生的反应为Fe3O4和H2反应生成FeO和H2O,据此写出反应的化学方程式;
(3)①根据图表数据分析,随着反应温度的上升,平衡时CO2的体积分数上升,CO的体积分数下降,表明化学平衡向逆反应方向移动,据此判断反应的焓变情况;
②100℃时平衡体系中CO2和CO的体积分数分别和200℃时的一样,而反应是放热反应,升高温度平衡常数会改变,据此推断,反应温度从100℃变为200℃的过程中,正反应趋势应为先升高,后降低,据此判断150℃时进行上述转化的理论转化率ɑ(FeO);
③反应为CO2(g)+3FeO(s)?Fe3O4(s)+CO (g),是气体数不变的反应,压强变化不对平衡常产生影响,结合焓变情况分析温度变化的影响,据此判断反应达到平衡的标志;
④根据化学反应原理,CO2还原器温度设置在170℃的原因,可考虑化学反应速率和化学反应趋势,综合考虑解答.
解答 解:(1)①已知CO、H2与CH3OCH3的燃烧热(△H)分别为a kJ/mol、b kJ/mol、c kJ/mol、(a、b、c均小于0),则三者的热化学方程式为:
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H1=akJ/mol,
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2=bkJ/mol,
③CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H3=ckJ/mol,
所求反应式为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),该反应可由①×3+②×3-③得到,根据盖斯定律,该反应的焓变为△H=3△H1+3△H2-△H3=(3a+3b-c)kJ/mol,
故答案为:(3a+3b-c);
②催化剂能降低反应的活化能,增大化学反应速率,但不改变化学的平衡,也不改变反应的焓变,故选B、C,
故答案为:B、C;
(2)①化学平衡常数K只随温度的改变而改变,所以随着随着压强的增大,反应ⅰ的平衡常数K值不变,
故答案为:不变;
②根据图象分析,随着反应的进行,H2的含量降低,H2O的含量增大,可推断反应过程中H2转化为了H2O,发生的反应为Fe3O4和H2反应生成FeO和H2O,则发生反应的化学方程式为:Fe3O4+H2$\frac{\underline{\;高温\;}}{\;}$3FeO+H2O,
故答案为:Fe3O4+H2$\frac{\underline{\;高温\;}}{\;}$3FeO+H2O;
(3)①根据图表数据分析,随着反应温度的上升,平衡时CO2的体积分数上升,CO的体积分数下降,表明化学平衡向逆反应方向移动,所以升高温度,化学反应向逆反应方向移动,表明正反应方向为放热反应,所以反应的焓变△H<0,
故答案为:<;
②100℃时平衡体系中CO2和CO的体积分数分别和200℃时的一样,而反应是放热反应,升高温度平衡常数会改变,据此推断,反应温度从100℃变为200℃的过程中,正反应趋势应为先升高,后降低,不妨取CO2的总量为1,若FeO起始量也取为1,平衡时,CO2的量为0.67,反应转化了CO2的量为1-0.67=0.33,此时转化了FeO的量为0.33×3=0.99≈1,150℃时,转化率增加,因此理论上若在150℃时进行上述转化,则理论转化率ɑ(FeO)可以达到100%,主要是考虑到反应为气相反应,固体的量并不影响化学的平衡,
故答案为:100%;
③反应为CO2(g)+3FeO(s)?Fe3O4(s)+CO (g),是气体数不变的反应,压强变化不对平衡常产生影响,该反应的焓变△H<0,反应为放热反应,
A.体系的压强整个反应过程不发生改变,根据压强不能判断反应是否达到化学平衡,故A错误;
B.CO2的物质的量不变,达到化学平衡时,该反应的CO2的物质的量不发生改变,可以判断化学反应是否达到平衡,故B正确;
C.CO的生成速率和消耗速率相等且不等于零,可以判断化学反应是否达到平衡,故C正确;
D.气体的平均摩尔质量$\overline{M}=\frac{m(气体)}{2}$,气体的总质量会发生改变,整个体系的质量不发生改变,当达到化学平衡时,气体的总质量不变,此时气体的平均摩尔质量也不变,可以判断化学反应是否达到平衡,故D正确.
故选BCD;
④根据化学反应原理,CO2还原器温度设置在170℃的原因,可考虑化学反应速率和化学反应趋势,温度过高,反应向逆反应方向移动,导致CO2的转化率低,温度过低,反应速率比较慢,
故答案为:温度过高,CO2的转化率低;温度过低,反应速率比较慢.
点评 本题考查化学原理部分知识,包含燃烧热的含义,盖斯定律的应用,化学平衡的移动,化学方程式的书写,化学平衡的判断,温度对化学反应速率的影响,题目涉及的知识点较多,有助于培养综合分析问题的能力,另外需注意,燃烧热是1mol物质完全燃烧,生成标准参考物质时,放出的热量,对于标准参考物质,C变成CO2(g),H2变成H2O(l),注意不是H2O(g),这是易错点,题目难度中等.

 考前必练系列答案
考前必练系列答案| A. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | B. | c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | ||
| C. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | D. | c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| A. | 已溶解的溶质和未溶解的溶质质量相等 | |
| B. | 溶解和结晶均停止,溶质达到溶解平衡状态 | |
| C. | 升高温度,饱和溶液将变为不饱和溶液 | |
| D. | 溶质的溶解和结晶继续进行,且速率相等 |
根据右表提供的数据可知,在溶液中能大量共存的微粒组是( )
化学式 | 电离常数 |
CH3COOH | K=1.7×10﹣5 |
HCN | K=4.9×10﹣10 |
H2CO3 | K1=4.3×10﹣7,K2=5.6×10﹣11 |
A.H2CO3、HCO3﹣、CH3COO﹣、CN﹣  B.HCO3﹣、CH3COOH、CN﹣、CO32﹣
B.HCO3﹣、CH3COOH、CN﹣、CO32﹣
C.HCN、HCO3﹣、CN﹣、CO32﹣ D.HCN、HCO3﹣、CH3COO﹣、CN﹣
| A. | 51 | B. | 54 | C. | 235 | D. | 92 |
①乙醇和二甲醚
②正丁烷和异丁烷
③金刚石和富勒烯
④${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2
⑤蔗糖和麦芽糖
⑥蛋白质和氨基酸.
| A. | ③④⑥ | B. | ①②④ | C. | ①②⑤ | D. | ③⑤⑥ |
| A. | 氦气可用于填充飞艇 | B. | 氯气用于自来水杀菌消毒 | ||
| C. | 二氧化硫作纸浆的漂白剂 | D. | 肥皂水作蚊虫叮咬处的淸洗剂 |




