题目内容
6.放射性元素${\;}_{92}^{238}$U的原子核内的中子数和核外电子数之差为( )| A. | 51 | B. | 54 | C. | 235 | D. | 92 |
分析 质量数=质子数+中子数,元素符号${\;}_{92}^{238}$U的左上角为质量数、左下角为质子数,据此进行计算.
解答 解:${\;}_{92}^{238}$U的质量数为238、质子数为92,该原子的中子数=238-92=146,原子的核外电子总数=质子数,所以${\;}_{92}^{238}$U的中子数和核外电子数之差=146-92=54,
故选B.
点评 本题考查质量数与质子数、中子数的关系,题目难度不大,明确原子构成为解答关键,注意掌握质量数与质子数、中子数的关系.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
17.下列关于铜电极的叙述中不正确的是( )
| A. | 锌、铜电极和稀硫酸溶液构成的原电池中铜是正极 | |
| B. | 在镀件上镀铜时可用金属铜作阳极 | |
| C. | 用电解法精炼粗铜时粗铜发生氧化反应 | |
| D. | 用电解法精炼粗铜时纯铜作阳极 |
下列对实验现象的解释与结论均正确的是( )
选项 | 实验操作 | 实验现象 | 解释与结论 |
A | 向某溶液中加入BaCl2溶液 | 有白色沉淀产生 | 生成了难溶于水的BaSO4,该溶液中一定含有SO42﹣ |
B | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加少量稀NaI溶液 | 开始有白色沉淀生成,后有黄色沉淀生成 | Ksp(AgI)<Ksp(AgCl) |
C | 向苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 苯和溴水发生取代反应,使溴水褪色 |
D | 向蔗糖中加入浓硫酸 | 变黑,放热,体积膨胀,放出刺激性气体 | 浓硫酸具有吸水性和强氧化性,反应中生成C、SO2和CO2等 |
1.一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3)的原理如图1:
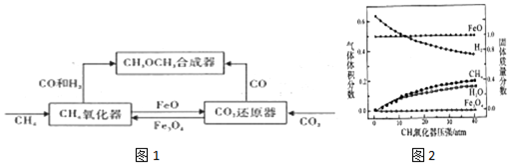
(1)二甲醚的合成反应:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H1
①已知CO、H2与CH3OCH的燃烧热(△H)分别为a kJ•mol-1、b kJ•mol-1、c kJ•mol-1、(a、b、c均小于0),则△H1=(3a+3b-c)kJ•mol-1.
②该反应选用CuO/ZnO/Al2O3复合催化剂,该催化剂能B、C(填标号).
A.促进平衡正向移动 B.提高反应速率
C.降低反应的活化能 D.改变反应的焓变
(2)CH4氧化器中发生的主反应:
ⅰ.CH4(g)+Fe3O4(s)?CO(g)+2H2(g)+3Fe(s)
ⅱ.CH4(g)+4Fe3O4(s)?CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如图2.
①随着压强的增大,反应ⅰ的平衡常数K值不变 (填“增大”、“减小”、或“不变”)
②结合图象,分析H2O的体积分数变化的原因Fe3O4+H2$\frac{\underline{\;高温\;}}{\;}$3FeO+H2O(用化学方程式表示)
(3)将一定量的FeO和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:
CO2(g)+3FeO(s)?Fe3O4(s)+CO (g)△H2
保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如表:
①△H2< 0(填“>”或“<”).
②若在150℃时进行上述转化,理论转化率ɑ(FeO)=100%.
③在上述反应体系中,一定可以说明该反应达到平衡状态的是B、C、D(填标号).
A.体系的压强不变 B.CO2的物质的量不变
C.CO的生成速率和消耗速率相等且不等于零 D.气体的平均摩尔质量不变
④根据化学反应原理,分析CO2还原器温度设置在170℃的原因温度过高,CO2的转化率低;温度过低,反应速率比较慢.

(1)二甲醚的合成反应:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H1
①已知CO、H2与CH3OCH的燃烧热(△H)分别为a kJ•mol-1、b kJ•mol-1、c kJ•mol-1、(a、b、c均小于0),则△H1=(3a+3b-c)kJ•mol-1.
②该反应选用CuO/ZnO/Al2O3复合催化剂,该催化剂能B、C(填标号).
A.促进平衡正向移动 B.提高反应速率
C.降低反应的活化能 D.改变反应的焓变
(2)CH4氧化器中发生的主反应:
ⅰ.CH4(g)+Fe3O4(s)?CO(g)+2H2(g)+3Fe(s)
ⅱ.CH4(g)+4Fe3O4(s)?CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如图2.
①随着压强的增大,反应ⅰ的平衡常数K值不变 (填“增大”、“减小”、或“不变”)
②结合图象,分析H2O的体积分数变化的原因Fe3O4+H2$\frac{\underline{\;高温\;}}{\;}$3FeO+H2O(用化学方程式表示)
(3)将一定量的FeO和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:
CO2(g)+3FeO(s)?Fe3O4(s)+CO (g)△H2
保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如表:
| 温度I/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
| CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
| CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
②若在150℃时进行上述转化,理论转化率ɑ(FeO)=100%.
③在上述反应体系中,一定可以说明该反应达到平衡状态的是B、C、D(填标号).
A.体系的压强不变 B.CO2的物质的量不变
C.CO的生成速率和消耗速率相等且不等于零 D.气体的平均摩尔质量不变
④根据化学反应原理,分析CO2还原器温度设置在170℃的原因温度过高,CO2的转化率低;温度过低,反应速率比较慢.
11.下列物质互为同分异构体的一组是( )
| A. | 甲烷和乙烷 | B. | 丙烯和环丙烷 | C. | l2C与14C | D. | O2和O3 |
15.下列分子式对应的物质只有一种结构的是( )
| A. | C6H6O | B. | C2H4Cl2 | C. | C6H12O6 | D. | CH5N |
16. 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Na+、Mg2+、S O42-、HCO3- | |
| B. | b点对应的溶液中:Na+、NH4+、SO42- | |
| C. | c点对应的溶液中:Ag+、Ca2+、N O3- | |
| D. | d点对应的溶液中:K+、NH4+、I-、SO42- |
 ;
;