题目内容
13.某学习小组按如下实验流程制取连二亚硫酸钠(Na2S2O4)并进行纯度 的测定.实验(一)连二亚硫酸钠的制取

连二亚硫酸钠的相关性质:
①可溶于水,但不溶于乙醇
②具有强还原性
③能与AgNO3在溶液中以物质的量比1:2反应
实验(二)连二亚硫酸钠的纯度测定
称取粗产品5.000g加水溶解,用NaOH溶液碱化后,加入一定量的AgNO3溶液 恰好完全反应,将溶液中生成的纳米级的银粉过滤、洗涤、干燥后称重,得到银4.320g. 请回答下列问题:
(1)实验(一)步骤①中常温下通入气体A的化学式为SO2
(2)实验(一)步骤②中加入NaCl固体的作用为降低Na2S2O4的溶解度或增大Na+的浓度以便于Na2S2O4析出,过滤后用含少量水的乙醇(填试剂名称)洗涤、再干燥后就可以得到较纯净的连二亚硫酸钠.
(3)连二亚硫酸钠在碱性条件下与AgNO3溶液反应的离子方程式为2Ag++S2O42-+4OH-═2Ag↓+2SO32-+2H2O
根据相关数据,计算粗产品中连二亚硫酸钠的质量分数69.60%
(4)测出的连二亚硫酸钠的纯度比实际值小,若排除实验过程中的操作误差,则可能的原因是生成的纳米级的银粉有部分穿过滤纸到滤液中去了.
分析 实验流程的目的是制取连二亚硫酸钠(Na2S2O4)并进行纯度的测定,根据流程图分析,锌粉加水形成分散系,为悬浊液,通入气体A调至溶液pH=3,产生B溶液ZnS2O4溶液,根据元素守恒,通入的气体含有S元素,则A应为SO2气体,向B溶液加入18%的NaOH溶液,生成沉淀为Zn(OH)2,溶液C为Na2S2O4溶液,加入NaCl固体冷却至20℃,溶液D为NaCl溶液,固体为Na2S2O4,制得粗产品,结合Na2S2O4的相关性质,据此分析.
解答 解:(1)实验(一)步骤①中常温下通入气体A,调至溶液pH=3,产生B溶液ZnS2O4溶液,根据元素守恒,通入的气体含有S元素,则A应为SO2气体,化学式为SO2,
故答案为:SO2;
(2)实验(一)步骤②中加入NaCl固体,析出了Na2S2O4固体,可见加入了NaCl,使Na2S2O4的溶解度降低,则加入NaCl固体的作用为:降低Na2S2O4的溶解度或增大Na+的浓度以便于Na2S2O4析出,
已知Na2S2O4可溶于水,但不溶于乙醇,因此洗涤固体时,用含有少量水的乙醇洗涤,
故答案为:降低Na2S2O4的溶解度或增大Na+的浓度以便于Na2S2O4析出;含少量水的乙醇;
(3)连二亚硫酸钠在碱性条件下与AgNO3溶液反应,已知Na2S2O4能与AgNO3在溶液中以物质的量比1:2反应
,具有强还原性,反应为氧化还原反应,Ag+被还原为Ag,根据电子得失守恒,2molAg+得到2mol电子,则1molS2O42-反应失去2mol电子,据此判断,S2O42-被氧化为SO32-,则反应的离子方程式为:2Ag++S2O42-+4OH-═2Ag↓+2SO32-+2H2O,
根据相关数据,称取粗产品5.000g加水溶解,用NaOH溶液碱化后,加入一定量的AgNO3溶液恰好完全反应,将溶液中生成的纳米级的银粉过滤、洗涤、干燥后称重,得到银4.320g,则得到Ag的物质的量为n(Ag)=$\frac{4.320g}{108g/mol}$=0.04mol,根据反应方程式,消耗的Na2S2O4的物质的量为n(Na2S2O4)=0.02mol,质量为m=0.02mol×174g/mol=3.48g,则粗产品中连二亚硫酸钠的质量分数为w=$\frac{m}{5.000g}×100%$=69.60%,
故答案为:2Ag++S2O42-+4OH-═2Ag↓+2SO32-+2H2O;69.60%;
(4)测出的连二亚硫酸钠的纯度比实际值小,表明相对于实际而言,反应少生成了Na2S2O4,而计算产生的Na2S2O4的量是通过产生的银粉计算的,则可认为是少生了部分银粉,若排除实验过程中的操作误差,考虑到反应产生了纳米级的银粉,过滤时,纳米级银粉会穿过滤纸到滤液中,这一部分银粉称量时就是损耗了,导致实际上银粉质量偏少,也就导致测出的连二亚硫酸钠的纯度比实际值小,则可能的原因为:生成的纳米级的银粉有部分穿过滤纸到滤液中去了,
故答案为:生成的纳米级的银粉有部分穿过滤纸到滤液中去了.
点评 本题考查Na2S2O4的制取流程,属无机化学流程,根据流程图,结合已知的Na2S2O4的相关性质,弄清楚每步流程的内容和反应是解题的关键,牢牢把握守恒思想,题目难度中等.值得一提的是,连二亚硫酸钠,又被称为保险粉,具有一定的还原性.

| A. |  | B. | CF2═CF2 | C. | CH≡C-CH═CH2 | D. |  |
| A. | CH4 | B. | C2H4 | C. | C2H6 | D. | C4H10 |
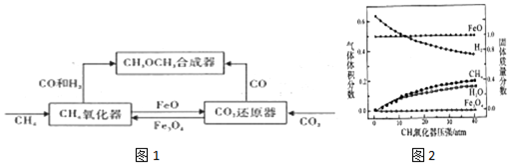
(1)二甲醚的合成反应:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H1
①已知CO、H2与CH3OCH的燃烧热(△H)分别为a kJ•mol-1、b kJ•mol-1、c kJ•mol-1、(a、b、c均小于0),则△H1=(3a+3b-c)kJ•mol-1.
②该反应选用CuO/ZnO/Al2O3复合催化剂,该催化剂能B、C(填标号).
A.促进平衡正向移动 B.提高反应速率
C.降低反应的活化能 D.改变反应的焓变
(2)CH4氧化器中发生的主反应:
ⅰ.CH4(g)+Fe3O4(s)?CO(g)+2H2(g)+3Fe(s)
ⅱ.CH4(g)+4Fe3O4(s)?CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如图2.
①随着压强的增大,反应ⅰ的平衡常数K值不变 (填“增大”、“减小”、或“不变”)
②结合图象,分析H2O的体积分数变化的原因Fe3O4+H2$\frac{\underline{\;高温\;}}{\;}$3FeO+H2O(用化学方程式表示)
(3)将一定量的FeO和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:
CO2(g)+3FeO(s)?Fe3O4(s)+CO (g)△H2
保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如表:
| 温度I/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
| CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
| CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
②若在150℃时进行上述转化,理论转化率ɑ(FeO)=100%.
③在上述反应体系中,一定可以说明该反应达到平衡状态的是B、C、D(填标号).
A.体系的压强不变 B.CO2的物质的量不变
C.CO的生成速率和消耗速率相等且不等于零 D.气体的平均摩尔质量不变
④根据化学反应原理,分析CO2还原器温度设置在170℃的原因温度过高,CO2的转化率低;温度过低,反应速率比较慢.
| A. | ${\;}_{1}^{1}$H2O和${\;}_{1}^{2}$H2O | B. | 甲烷和乙烷 | ||
| C. | 石墨和C60 | D. | 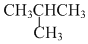 和CH3CH2CH2CH3 和CH3CH2CH2CH3 |
| A. | H2SO4的摩尔质量是98 | |
| B. | 等质量的O2和O3中所含的氧原子数相同 | |
| C. | 等物质的量的CO与CO2中所含碳原子数之比为2:7 | |
| D. | 将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol/L |
| A. | (CH3)2CH CH2 CH2CH3 | B. | (CH3 CH2)2CHCH3 | ||
| C. | (CH3)3CCH2CH3 | D. | (CH3)2CHCH(CH3)2 |
 ;
;