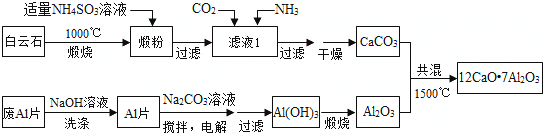
题目内容
2.下列说法中不正确的是( )| A. | 人类历史上使用最早的合金是青铜 | |
| B. | 目前世界上用量最大的合金是钢 | |
| C. | 改变原料的配比、改变生成合金的条件,可以得到具有不同性质的合金 | |
| D. | 一般合金的熔点高于它的各成分金属 |
分析 合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质.
解答 解:A、人类历史上使用最早的合金是青铜,故A正确;
B、目前世界上使用量最大的合金是钢铁,故B正确;
C、合金的性能与其成分、原料配比及合成条件都有关系,所以改变原料的配比、改变生成合金的条件,得到有不同性能的合金,故C正确;
D、一般合金的熔点低于它的各成分金属,故D错误,
故选D.
点评 本题以合金为载体考查了化学发展史,难度不大,注意基础知识的积累.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
12.0.12mol/L的NaCl、MgCl2、AlCl3三种溶液500mL中Cl-的物质的量浓度( )
| A. | 相同 | |
| B. | 无法比较 | |
| C. | 依次为0.12mol/L、0.24mol/L、0.36mol/L | |
| D. | 依次为0.06mol/L、0.12mol/L、0.18mol/L |
13.将一定质量的Mg、Al混合物与足量稀H2SO4反应,生成H2 11.2L(标准状况),原混合物的质量可能是( )
| A. | 2g | B. | 4g | C. | 8g | D. | 10g |
17.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4LHF中含有的分子数目为NA | |
| B. | .1 L 0.1mol/L 的FeCl3溶液中,Fe3+的数目为0.1NA | |
| C. | .标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA | |
| D. | .5.6gFe在0.1molCl2中充分燃烧,转移的电子数目为0.2NA |
14.下列变化,必须要加入氧化剂才能实现的是( )
| A. | HCl→H2 | B. | H2O2→O2 | C. | H2SO4→SO2 | D. | Fe→Fe3O4 |
12.短周期元素W、X、Y、Z在元素周期表中的位置如表所示,其中Z的单质,是一种重要半导体材料.广泛应用于电子工业的各个领域.
(1)W在元素周期表中的位位置是第二周期第ⅣA族
(2)Z的原子结构示意图为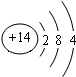
(3)X和Y离子半径最大的是N3-(填离子符号)
(4)下列选项中.能证明元素非佥属性X强于W的是CD
A.原子序数:W>X B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(5)写出表中Y的最高价氧化物对应水化物的电离方程式Mg(OH)2?Mg2++2OH-
(6)元素周期表中与同Z同期的某金属元素形成的单质A,可发生如图所示的转化
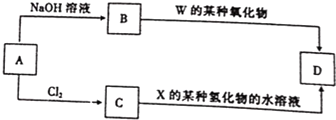
其中化含物D是-种白色沉淀,则生成物B的化学式为NaAlO2,C转化生成D的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
| W | X | ||
| Y | Z |
(2)Z的原子结构示意图为

(3)X和Y离子半径最大的是N3-(填离子符号)
(4)下列选项中.能证明元素非佥属性X强于W的是CD
A.原子序数:W>X B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(5)写出表中Y的最高价氧化物对应水化物的电离方程式Mg(OH)2?Mg2++2OH-
(6)元素周期表中与同Z同期的某金属元素形成的单质A,可发生如图所示的转化

其中化含物D是-种白色沉淀,则生成物B的化学式为NaAlO2,C转化生成D的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.