题目内容
17.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 标准状况下,22.4LHF中含有的分子数目为NA | |
| B. | .1 L 0.1mol/L 的FeCl3溶液中,Fe3+的数目为0.1NA | |
| C. | .标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA | |
| D. | .5.6gFe在0.1molCl2中充分燃烧,转移的电子数目为0.2NA |
分析 A、标况下HF为液态;
B、铁离子是弱碱阳离子;
C、氯气和水的反应为可逆反应;
D、求出铁的物质的量,然后根据1molFe~$\frac{3}{2}$molCl2来分析.
解答 解:A、标况下HF为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、铁离子是弱碱阳离子,在溶液中会水解,故溶液中的铁离子的个数小于0.1NA个,故B错误;
C、氯气和水的反应为可逆反应,不能完全反应,故转移的电子数小于0.1NA个,故C错误;
D、5.6g铁的物质的量为0.1mol,而1molFe~$\frac{3}{2}$molCl2,故0.1mol氯气要想反应完全,需要0.15mol氯气,故铁过量,氯气能完全反应,由于氯气反应后变为-1价,故0.1mol氯气转移0.2mol电子即0.2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
7.化学与生产、生活密切相关.下列说法不正确的是( )
| A. | 闻名世界的中国陶瓷、酿酒等技术都充分应用了化学工艺 | |
| B. | 四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 打磨磁石制作指南针为化学变化 |
8.镍是有机合成的重要催化剂,某化工厂有含镍催化剂废品(主要成分是镍、杂质是铁、铝单质及其化合物,还有少量难溶性杂质).某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:

几种难溶碱开始沉淀和完全沉淀的pH:
回答下列问题:
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O;双氧水可以用下列物质替代的是A.
A.氧气 B.漂白液 C.氯气 D.硝酸
(3)操作a和c需要共同的玻璃仪器是玻璃棒;操作C的名称是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)如果加入双氧水量不足或“保温时间较短”,则所制备的产品可能含有的杂质为产品中混有绿矾;请选择合适的试剂,设计实验证明产品中是否含“杂质”取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有亚铁离子.
(5)含镍金属氢化物MH-Ni燃料电池是一种绝色环保电池,广泛应用于电动汽车.其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M $?_{放电}^{充电}$ MHx+xNiOOH;电池充电过程中阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O,放电时负极的电极反应式为MHx+xOH--xe-=M++xH2O.

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O;双氧水可以用下列物质替代的是A.
A.氧气 B.漂白液 C.氯气 D.硝酸
(3)操作a和c需要共同的玻璃仪器是玻璃棒;操作C的名称是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)如果加入双氧水量不足或“保温时间较短”,则所制备的产品可能含有的杂质为产品中混有绿矾;请选择合适的试剂,设计实验证明产品中是否含“杂质”取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有亚铁离子.
(5)含镍金属氢化物MH-Ni燃料电池是一种绝色环保电池,广泛应用于电动汽车.其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M $?_{放电}^{充电}$ MHx+xNiOOH;电池充电过程中阳极的电极反应式为Ni(OH)2+OH--e-=NiOOH+H2O,放电时负极的电极反应式为MHx+xOH--xe-=M++xH2O.
5.下列叙述中不正确的是( )
| A. | 用SiO2制备硅酸不可能一步完成 | |
| B. | 使用澄清的石灰水可以鉴别Na2CO3和NaHCO3两种白色固体 | |
| C. | 把铁粉和铜粉放入FeCl3溶液充分反应后有固体剩余,固体中可能有铜无铁 | |
| D. | 烧碱溶液应保存在塞有橡胶塞的细口玻璃瓶中 |
12.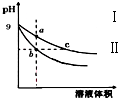 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )
 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )| A. | b、c两点溶液的导电能力相同 | |
| B. | a、b、c三点溶液中水的电离程度a>c>b | |
| C. | c点溶液中c (H+)=c (OH-)+c (CH3COOH) | |
| D. | 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积 Vb=Vc |
2.下列说法中不正确的是( )
| A. | 人类历史上使用最早的合金是青铜 | |
| B. | 目前世界上用量最大的合金是钢 | |
| C. | 改变原料的配比、改变生成合金的条件,可以得到具有不同性质的合金 | |
| D. | 一般合金的熔点高于它的各成分金属 |
9.下列仪器对应的名称正确的是 ( )
| A. |  三脚架 | B. |  酸式滴定管 酸式滴定管 | C. |  长颈漏斗 | D. |  蒸发皿 |
7.Cl2是纺织工业中常用的漂白剂.Na2S2O3可作漂白布匹后的“脱氯剂”,脱氯反应为S2O32-+Cl2++H20→SO42-+Cl-+H+ (未配平),下列对该反应的说法不正确的是( )
| A. | 反应每脱去1mol Cl2会生成1molSO42- | |
| B. | 脱氯反应后的溶液显酸性 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | 反应中硫元素发生了氧化反应 |
