题目内容
17.足量的铜与一定量的浓硝酸反应得到硝酸铜溶液和NO、NO2 的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.则和铜反应的硝酸的物质的量可能是( )| A. | 0.4mol | B. | 0.55mol | C. | 0.6mol | D. | 0.65mol |
分析 根据电子得失守恒,求出参加反应的铜,然后求出 Cu(NO3)2,依据电子守恒计算得到钡还原的硝酸物质的量范围,计算和铜反应的物质的量范围进行判断.
解答 解:混合后通入水中,所有气体完全被水吸收完全生成HNO3,则整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到,
根据得失电子守恒:n(Cu)×2=n(O2)×4
n(Cu)×2=$\frac{1.68L}{22.4L/mol}$mol×4,解得:n(Cu)=0.15mol,
所以 Cu(NO3)2 为0.15mol,电子转移的物质的量为:0.15mol×2=0.3mol;
HNO3~NO~3e-
0.1 0.3
HNO3~NO2~e-
0.3 0.3
所以做氧化剂的硝酸物质的量为0.1~0.3之间,则反应的硝酸物质的量在0.4~0.6之间,
故选B.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握守恒思想、极值法在化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
7.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) | |
| B. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1 mol/L Na2CO3溶液:c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] |
8.常温下,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)与c(H+)之比为1012,将两溶液等体积混合,以下判断正确的是( )
| A. | HA是一种强酸 | B. | 反应后溶液中c(OH-)<c(H+) | ||
| C. | c(A-)>c(B+)>c(H+)>c(OH-) | D. | 反应后混合溶液中还含有HA分子 |
5.化学反应经常伴随着颜色变化,下列关于颜色的叙述正确的是( )
①钾的焰色反应--紫色;②淀粉碘化钾溶液遇碘离子--蓝色;③溴化银见光分解--白色;④适量的氯气通入KBr溶液--橙色;⑤新制氯水久置后--无色;⑥铜在氯气中燃烧产生的烟--棕黄色.
①钾的焰色反应--紫色;②淀粉碘化钾溶液遇碘离子--蓝色;③溴化银见光分解--白色;④适量的氯气通入KBr溶液--橙色;⑤新制氯水久置后--无色;⑥铜在氯气中燃烧产生的烟--棕黄色.
| A. | ①②③⑤ | B. | ①④⑤⑥ | C. | ②③④⑥ | D. | ①③④⑤⑥ |
12.要把12mol/L盐酸(d=1.19g/cm3)50mL稀释成6mol/L盐酸(d=1.10g/cm3),需加水( )
| A. | 50.5 mL | B. | 50 mL | C. | 60 mL | D. | 59.5 mL |
2.工业上合成丁苯橡胶的反应如下(反应条件已略去):
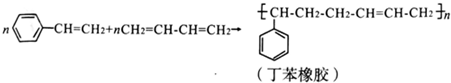
下列有关说法错误的是( )

下列有关说法错误的是( )
| A. | 丁苯橡胶的两种单体都属于烃 | B. | 丁苯橡胶不能使溴水褪色 | ||
| C. | 上述反应的原子利用率为100% | D. | 丁苯橡胶属于高分子化合物 |
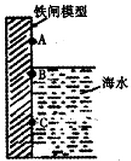 铁闸中的A、B、C三点中,C点的电极反应方程式为Fe-2e-=Fe2+将此铁闸与电源的负极相连可起到保护该铁闸的作用.对铁制品进行钝化处理可提高其抗腐蚀能力,下面是处理过程中的一个反应的方程式为:请配平该反应方程式.
铁闸中的A、B、C三点中,C点的电极反应方程式为Fe-2e-=Fe2+将此铁闸与电源的负极相连可起到保护该铁闸的作用.对铁制品进行钝化处理可提高其抗腐蚀能力,下面是处理过程中的一个反应的方程式为:请配平该反应方程式.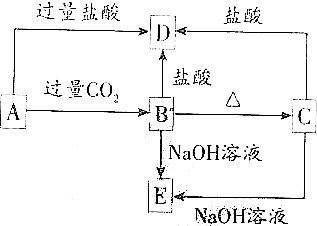 A、B、C、D、E五种化合物均含有某种短周期常见元素,它们的转化关系如图所示,其中A的溶液为澄清溶液,C为难溶于水的白色固体,E易溶于水,取A的溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)
A、B、C、D、E五种化合物均含有某种短周期常见元素,它们的转化关系如图所示,其中A的溶液为澄清溶液,C为难溶于水的白色固体,E易溶于水,取A的溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃) 、醛基-CHO、羧基-COOH.
、醛基-CHO、羧基-COOH.