题目内容
6.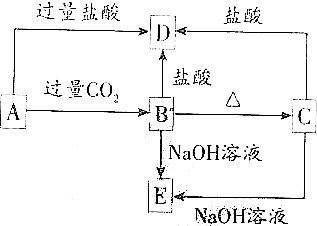 A、B、C、D、E五种化合物均含有某种短周期常见元素,它们的转化关系如图所示,其中A的溶液为澄清溶液,C为难溶于水的白色固体,E易溶于水,取A的溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)
A、B、C、D、E五种化合物均含有某种短周期常见元素,它们的转化关系如图所示,其中A的溶液为澄清溶液,C为难溶于水的白色固体,E易溶于水,取A的溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)(1)写出下列物质的化学式:AKAlO2,BAl(OH)3,CAl2O3,DAlCl3,ENaAlO2;
(2)写出下列反应的离子方程式:A→B:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
A→D:AlO2-+4H+=Al3++2H2O
C→E:Al2O3+2OH-═2AlO2-+H2O
B→D:Al(OH)3+3H+═Al3++3H2O.
分析 B、C都既能与盐酸反应又能与NaOH溶液反应,应为两性化合物,因B加热分解可生成C,则可知B为Al(OH)3,C为A12O3,则D为AlCl3,E为NaAlO2,若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片),说明A中含有K元素,A能与二氧化碳反应生成Al(OH)3,则A应为KAlO2,结合对应物质的性质解答该题.
解答 解:B、C都既能与盐酸反应又能与NaOH溶液反应,应为两性化合物,因B加热分解可生成C,则可知B为Al(OH)3,C为A12O3,则D为AlCl3,E为NaAlO2,若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片),说明A中含有K元素,A能与二氧化碳反应生成Al(OH)3,则A应为KAlO2,
(1)通过以上分析知,A、B、C、D、E分别是KAlO2、Al(OH)3、A12O3、AlCl3、NaAlO2,
故答案为:KAlO2;Al(OH)3;Al2O3;AlCl3;NaAlO2;
(2)A→B的反应为AlO2-和Al(OH)3的转化,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
A→D的反应为AlO2-和Al3+的转化,反应的离子方程式为:AlO2-+4H+=Al3++2H2O,
C→E的反应的离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
B→D的反应的离子方程式为:Al(OH)3+3H+═Al3++3H2O,
故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;AlO2-+4H+=Al3++2H2O;Al2O3+2OH-═2AlO2-+H2O;Al(OH)3+3H+═Al3++3H2O.
点评 本题考查了铝及其化合物之间的转化,根据B能和强酸、强碱反应且加热易分解推断知,B是氢氧化铝,再结合物质的反应条件、反应物来分析解答,难度中等,注意偏铝酸根离子和碳酸根离子不能共存,为易错点

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | 放电时,负极质量减少 | |
| B. | 放电一段时间后,溶液的pH值减小 | |
| C. | 充电时,阳极反应:PbSO4+2e-=Pb+SO42- | |
| D. | 充电时,铅蓄电池的负极与外接电源的负极相连 |
| A. | 0.4mol | B. | 0.55mol | C. | 0.6mol | D. | 0.65mol |
| A. | Ca2+的结构示意图为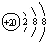 | B. | CO2分子的比例模型示意图: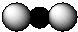 | ||
| C. | 水合钠离子: | D. | 次氯酸的电子式: |
| A. | 铬 | B. | 铁 | C. | 锰 | D. | 镁 |
| A. | 酸性 | B. | 酸性、氧化性 | ||
| C. | 酸性、还原性 | D. | 酸性、氧化性、还原性 |
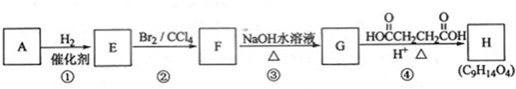
 ;
;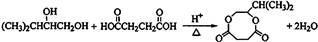 ;
;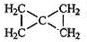 .
.