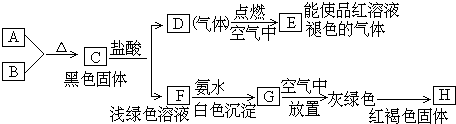
题目内容
2.粗氧化锌中含少量CuO、Fe3O4、SiO2等杂质,工业上以粗氧化锌为原料生产硫酸锌晶体(ZnSO4•7H2O)的工艺流程如所示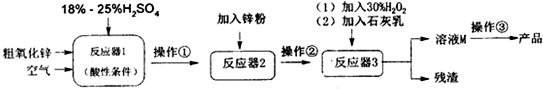
己知:常温下溶液中Fe3+,Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为3.7,6.5,9.7.
请回答下列问题:
(1)操作③的名称是蒸发浓缩、冷却结晶、过滤、洗涤、干燥加入适量锌粉的作用为使溶液中的Fe3+转化为Fe2+、除去Cu2+;
(2)加入30%H2O2反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Ca(OH)2不能过量的原因是防止生成Zn(OH)2
(4)已知:
H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H1=-1584.2kJ•mol
HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H2=-55.6kJ•mol
则Ba2+与SO42-生成BaSO4沉淀的热化学方程式为Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-1473kJ•mol-1
(5)肼-H2O2燃料电池是一种碱性电池,该电池放电时的正极反应为H2O2+2e-=2OH-
(6)粗氧化锌中Zn元素的质量分数为32.5%,处理a kg粗氧化锌,中间过程氧化锌的转化率为b,
最终制得172.2kgZnS04•7H20,则流程中加入的Zn粉质量为6.5×(6-5ab)kg.(ZnS04•7H20摩尔质量287g/mol)
分析 粗氧化锌中含少量CuO、Fe3O4、SiO2等杂质,加入硫酸,CuO、Fe3O4能够反应生成ZnSO4、CuSO4、Fe2(SO4)3,SiO2不和硫酸反应,加入锌粉后,由于锌粉具有还原性,能把三价铁离子还原成二价铁离子,同时把铜离子还原成铜单质析出,再加入H2O2,H2O2有强氧化性,能氧化二价铁离子为三价铁离子,方便把铁以氢氧化铁的形式除去,最后得到的溶液为ZnSO4溶液,据此解答.
解答 解:(1)粗氧化锌中含少量CuO、Fe3O4、SiO2等杂质,加入硫酸,溶液中有铜离子、三价铁离子和锌离子等,加入锌粉后铜被置换出来,加入双氧水后溶液中只有硫酸锌,从溶液中得到固体硫酸锌需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作过程,粗氧化锌中含少量CuO、Fe3O4、SiO2等杂质,加入硫酸,溶液中有铜离子、三价铁离子和锌离子等,锌粉具有还原性,能把三价铁离子还原成二价铁离子,同时把铜离子还原成铜单质析出;
故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;使溶液中的Fe3+转化为Fe2+、除去Cu2+;
(2)H2O2具有强氧化性,能氧化二价铁离子为三价铁离子,方便把铁以氢氧化铁的形式除去,发生的离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)加入适量Ca(OH)2调节溶液pH,是PH值小于6.5即可,若碱性过强,Zn(OH)2也会沉淀,使得硫酸锌晶体(ZnSO4•7H2O)量减少.
故答案为:防止生成Zn(OH)2 ;
(4)已知:①2H+(aq)+2OH-(aq)+Ba2+(aq)+SO42-(aq)═BaSO4(s)+2H2O(l)△H=-1584.2kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H1=-55.6kJ•mol-1
根据盖斯定律,则反应Ba2+(aq)+SO42-(aq)═BaSO4(s)等于①-②×2,所以△H=-1584.2kJ•mol-1-2×(-55.6kJ•mol-1)=-1473 kJ•mol-1,所以热反应方程式为Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-1473 kJ•mol-1,
故答案为Ba2+(aq)+SO42-(aq)═BaSO4(s)△H=-1473 kJ•mol-1;
(5)肼、H2O2碱性燃料电池中,肼所在电极为负极,正极上H2O2得电子生成氢氧根离子,电极反应式为:H2O2+2e-=2OH-,
故答案为:H2O2+2e-=2OH-;
(6)172.2kgZnS04•7H20中锌元素的物质的量为n=$\frac{m}{M}$=$\frac{172.2kg}{287g/mol}$=600mol,氧化锌中锌的物质的量n=$\frac{32500abg}{65g/mol}$=500abmol,根据锌元素质量守恒可知,流程中加入的Zn粉质量为m=n×M=65g/mol×(600mol-500abmol)=65×(600-500ab)g=6.5×(6-5ab)kg,
故答案为:6.5×(6-5ab).
点评 本题考查了物质的分离和提纯的方法和基本操作、热化学方程式、电极反应式、化学计算等,注意利用溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH不同除去相应的杂质离子是提纯中经常使用的方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | 该有机物分子式为C25H24 | |
| B. | 该多环芳烃属于稠环芳烃 | |
| C. | 该分子中最多可能有13个碳原子在同一平面上 | |
| D. | 该有机物能使酸性高锰酸钾溶液褪色 |
| A. | 4.5mol | B. | 5mol | C. | 5.5mol | D. | 6mol |
| A. | 固态Na2O2和熔融态NaHSO4中的阴、阳离子个数比均为1:1 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H8-2m+nR或RH8-2m+n | |
| D. | 元素周期表中L层电子为奇数的元素的化合价也都是奇数 |
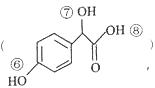 的说法正确的是( )
的说法正确的是( )| A. | Y 既能使溴水褪色又能使酸性高锰酸钾褪色,且原理相同 | |
| B. | Y 的同分异构体中,不存在苯环上的一氯代物只有一种的物质 | |
| C. | 1molY 与氢氧化钠溶液反应时,最多消耗 3mol 氢氧化钠 | |
| D. | Y 中⑥、⑦、⑧三处-OH 的电离程度由大到小的顺序是⑧>⑥>⑦ |
| A. | 甲基的电子式  | |
| B. | 乙醛的结构简式为CH3COH | |
| C. | 按系统命名法, 的名称为2,5-二甲基-3-乙基庚烷 的名称为2,5-二甲基-3-乙基庚烷 | |
| D. | 邻甲基苯酚的结构简式为 |
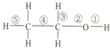 已知乙醇中不同的化学键如图,关于乙醇在各种不同反应中断裂的键的说明不正确的是( )
已知乙醇中不同的化学键如图,关于乙醇在各种不同反应中断裂的键的说明不正确的是( )| A. | 和浓H2SO4共热,140℃时键①②断裂 | B. | 在Ag催化下和O2反应键①③断裂 | ||
| C. | 和浓H2SO4共热,170℃时②⑤键断裂 | D. | 和氢溴反应键①断裂 |