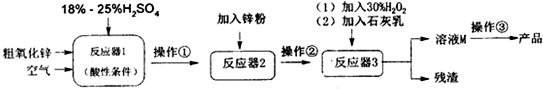
题目内容
17.下列叙述正确的是( )| A. | 固态Na2O2和熔融态NaHSO4中的阴、阳离子个数比均为1:1 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H8-2m+nR或RH8-2m+n | |
| D. | 元素周期表中L层电子为奇数的元素的化合价也都是奇数 |
分析 A、固态Na2O2中含有钠离子和过氧根离子;NaHSO4晶体中含有1个Na+和1个HSO4-;
B、离子化合物中可能含共价键;
C、化合物中元素的化合价代数和为零,据此计算X元素的化合价,再利用最高正化合价+|最低负化合价|=8,计算X元素在气态氢化物中的化合价;
D、L层电子为奇数,说明第二周期没排满,该元素在第二周期,再根据主族元素的化合价与其最外层电子数之间的关系判断.
解答 解:A、固态Na2O2中含有钠离子和过氧根离子,阴、阳离子个数比均为1:2;NaHSO4晶体中含有1个Na+和1个,NaHSO4晶体HSO4-中的阴、阳离子个数比均为1:1,故A错误;
B、离子化合物中可能含共价键,故B错误;
C、R的最高价含氧酸分子式为HnROm,化合物HnROm中各元素的化合价代数和为零,令R元素的化合价为a,则:(+1)×n+a+(-2)m=0,解得,a=2m-n,根据最高正化合价+|最低负化合价|=8可知,所以氢化物中化合价为最低化合价-(8-2m+n);根据化合物中各元素的化合价代数和为零可知,(+1)x+[-(8-2m+n)]=0,解得x=8-2m+n,则气态氢化物一般是H8-2m+nR或RH8-2m+n,故C正确;
D.L层电子为奇数,说明第二周期没排满,该元素在第二周期,L为奇数分别为1、3、5、7分别为锂、硼、氮、氟,L层电子为奇数的元素的化合价不一定也都是奇数,如其中的氮元素的化合价有+1、+2、+3、+4、+5,故D错误;
故选C.
点评 本题考查了离子晶体的构成、离子键、化合物中元素化合价的计算、原子结构与元素周期表,题目难度不大,注意常见主族的化合价.

练习册系列答案
相关题目
12.若以NA代表阿伏加德罗常数,则下列说法正确的是( )
| A. | 氯化氢的摩尔质量等于NA个氯化氢分子的质量 | |
| B. | 常温常压下1mol二氧化碳的体积大于22.4L | |
| C. | 64g金属铜发生氧化反应,一定失去2NA个电子 | |
| D. | 62g氧化钠溶于水后,所得溶液中含有NA个O2-离子 |
5.中国“十二五”规划明确提出到2015年单位GDP的二氧化碳排放比2010年要降低17%,下列措施不符合该规划要求的是( )
| A. | 用石头纸(主要成分CaCO3)代替普通纸,减少对木材的使用 | |
| B. | 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺的状况 | |
| C. | 将秸秆充分燃烧,避免秸秆腐烂造成环境污染 | |
| D. | 推广碳捕集和储存技术,逐步实现二氧化碳零排放 |
9.霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物,它在酸性溶液中能发生如下反应:
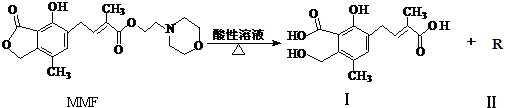
下列说法中正确的是( )

下列说法中正确的是( )
| A. | MMF分子中含有三种官能团 | |
| B. | 可以用NaHCO3溶液区别MMF与化合物Ⅰ | |
| C. | 化合物Ⅱ分子中只含碳、氢元素,属于烃类 | |
| D. | 1 mol MMF与足量NaOH 溶液共热,最多可消耗4 mol NaOH |
6.美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺.这项技术具有广泛的能源潜在用途,包括为汽车提供原料、潜水艇提供燃料等.该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气.合金中镓(Ga,ⅢA)是关键成分,可阻止铝形成致密的氧化膜.下列关于铝、镓的说法正确的是( )
| A. | 铝的金属性比镓强,铝的熔点比镓低 | |
| B. | 铝表面形成致密的氧化膜,所以可以用铝制容器来腌制咸菜 | |
| C. | Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应 | |
| D. | 铝镓合金与水反应后的物质可以回收利用冶炼铝 |
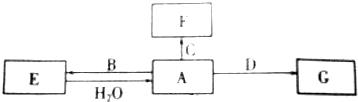
 ,写出E与H2O反应生成A的化学方程式2Na2O2+2H2O=4NaOH+O2↑
,写出E与H2O反应生成A的化学方程式2Na2O2+2H2O=4NaOH+O2↑