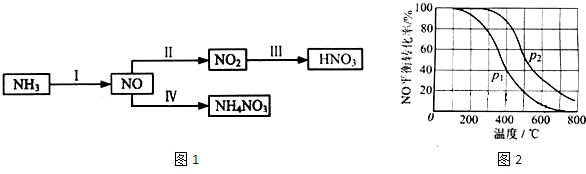
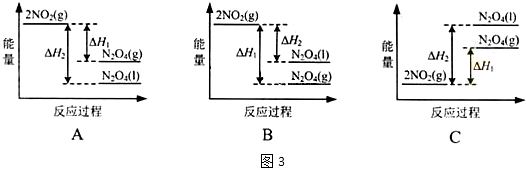
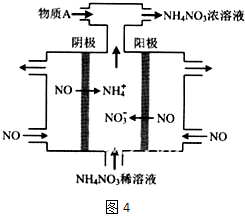
题目内容
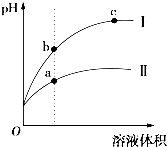 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示.据图判断不正确的是( )
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示.据图判断不正确的是( )| A、I是盐酸,Ⅱ是醋酸 |
| B、溶液的导电性a>b>c |
| C、a、b、c三点KW的数值相同 |
| D、稀释前等体积的 I、Ⅱ溶液中和氢氧化钠的能力相同 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:根据盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,故II应为醋酸稀释时的pH值变化曲线,利用a点、c点、b点溶液中的离子浓度来分析导电性;KW只与温度有关,与溶液的种类以及浓度大小没有关系.
解答:
解:A、I是盐酸稀释时的pH值变化曲线,II为醋酸稀释时的pH值变化曲线,故A正确;
B、溶液导电性取决于离子浓度,PH小时,H+浓度大,导电性强,则溶液的导电性a>b>c,故B正确;
C、KW的大小只取决于温度,所以a、b、c三点KW的数值相同,故C正确;
D、相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,所以等体积的 I、Ⅱ溶液中和氢氧化钠的能力II比I强,故D错.
故选D.
B、溶液导电性取决于离子浓度,PH小时,H+浓度大,导电性强,则溶液的导电性a>b>c,故B正确;
C、KW的大小只取决于温度,所以a、b、c三点KW的数值相同,故C正确;
D、相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,所以等体积的 I、Ⅱ溶液中和氢氧化钠的能力II比I强,故D错.
故选D.
点评:本题考查强弱电解质溶液稀释时的浓度变化,注意加水促进弱电解质电离的特点,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
将2.06g NaBr和0.42g NaF溶于水形成混合溶液,加足量的AgNO3溶液得到沉淀3.76g.下面叙述正确的是( )
| A、溴化钠只有一部分反应,氟化钠未反应 |
| B、氟化银溶于水 |
| C、沉淀是氟化银 |
| D、沉淀是氟化银与溴化银的混合物 |
科学家用催化剂将苯酚(X)和某有机物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述正确的是( )

| A、反应①属于加成反应 |
| B、W中至少含有3种官能团 |
| C、X、Y、W、Z中至少有一种物质不能与NaOH溶液反应 |
| D、可用溴水鉴别X和W |
某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为l:2,下列有关该有机物分子组成的推论正确的是( )
| A、分子中C、H、O个数之比为1:4:4 |
| B、分子中C、H个数之比为1:2 |
| C、分子中可能含有氧原子 |
| D、此有机物的最简式为CH4 |
实验室对某有机物有如下实验记录:4位同学据此分别提出以下4种该有机物可能的分子式,其中合理的是( )
①在氧气中完全燃烧,只生成CO2和H2O;
②完全燃烧1mol该有机物需消耗氧气112L(标准状况下).
①在氧气中完全燃烧,只生成CO2和H2O;
②完全燃烧1mol该有机物需消耗氧气112L(标准状况下).
| A、C2H6 |
| B、C4H8O2 |
| C、C3H10O |
| D、C5H10O3 |