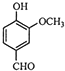
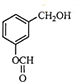
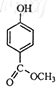
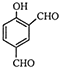
题目内容
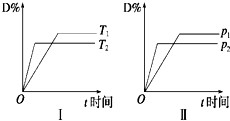 对于可逆反应mA(g)+nB(s)?pC(g)+qD(g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如图,下列说法正确的是( )
对于可逆反应mA(g)+nB(s)?pC(g)+qD(g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如图,下列说法正确的是( )| A、化学方程式中化学计量数:m>p+q |
| B、降温可使化学平衡向正反应方向移动 |
| C、使用合适的催化剂可使D%有所增加 |
| D、B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
考点:产物的百分含量随浓度、时间的变化曲线,化学平衡建立的过程
专题:化学平衡专题
分析:A.由图Ⅱ可知,P2>P1,增大压强,D的含量减小,平衡逆向移动;
B.由图Ⅰ可知,T2>T1,升高温度,D的含量减小,平衡逆向移动;
C.催化剂对化学平衡不产生影响;
D.B的颗粒越小,接触面积越大,可以加快化学反应速率,对化学平衡不产生影响.
B.由图Ⅰ可知,T2>T1,升高温度,D的含量减小,平衡逆向移动;
C.催化剂对化学平衡不产生影响;
D.B的颗粒越小,接触面积越大,可以加快化学反应速率,对化学平衡不产生影响.
解答:
解:A.由图Ⅱ可知,P2>P1,增大压强,D的含量减小,平衡逆向移动,故m<p+q,故A错误;
B.由图Ⅰ可知,T2>T1,升高温度,D的含量减小,平衡逆向移动,故降低温度,平衡正向移动,故B正确;
C.催化剂对化学平衡不产生影响,故C错误;
D.B的颗粒越小,接触面积越大,可以加快化学反应速率,对化学平衡不产生影响,故D错误,
故选B.
B.由图Ⅰ可知,T2>T1,升高温度,D的含量减小,平衡逆向移动,故降低温度,平衡正向移动,故B正确;
C.催化剂对化学平衡不产生影响,故C错误;
D.B的颗粒越小,接触面积越大,可以加快化学反应速率,对化学平衡不产生影响,故D错误,
故选B.
点评:本题考查外界条件对化学反应速率和化学平衡的影响,难度中等.要注意催化剂和颗粒大小对化学平衡不产生影响.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价.下列说法正确的是( )
| A、XH4的沸点比YH3高 |
| B、X与W形成的化合物和Z与W形成的化合物的化学键类型相同 |
| C、元素Y与W形成的化合物溶于水后具有漂白性 |
| D、X与Y形成的化合物可能是离子晶体 |
除去下列物质中的少量杂质,正确的是( )
| 选项 | 混合物 | 所用试剂 | 方法 |
| A | 乙酸乙酯和乙酸溶液 | 饱和Na2CO3溶液 | 分液 |
| B | 苯中的甲苯 | 溴水 | 分液 |
| C | 溴苯中的溴 | KI溶液 | 分液 |
| D | 乙烯中的SO2 | 溴水 | 洗气 |
| A、A | B、B | C、C | D、D |
将2.06g NaBr和0.42g NaF溶于水形成混合溶液,加足量的AgNO3溶液得到沉淀3.76g.下面叙述正确的是( )
| A、溴化钠只有一部分反应,氟化钠未反应 |
| B、氟化银溶于水 |
| C、沉淀是氟化银 |
| D、沉淀是氟化银与溴化银的混合物 |
下列各组性质对比正确的是( )
| A、原子半径:O>N>C |
| B、酸性:HClO4>H2SO4>H3PO4 |
| C、稳定性:HCl>HI>HBr |
| D、金属性:Al>Mg>Na |
实验室对某有机物有如下实验记录:4位同学据此分别提出以下4种该有机物可能的分子式,其中合理的是( )
①在氧气中完全燃烧,只生成CO2和H2O;
②完全燃烧1mol该有机物需消耗氧气112L(标准状况下).
①在氧气中完全燃烧,只生成CO2和H2O;
②完全燃烧1mol该有机物需消耗氧气112L(标准状况下).
| A、C2H6 |
| B、C4H8O2 |
| C、C3H10O |
| D、C5H10O3 |