题目内容
R和Q为短周期中的两种元素,R元素原子的最外层电子数和次外层电子数之差的绝对值等于电子层数;Q元素的原子比R元素的原子多2个核外电子,则下列叙述中肯定错误的是( )
| A、原子半径:R>Q |
| B、R和Q可形成离子化合物 |
| C、R和Q可形成非极性分子RQ2 |
| D、R和Q可形成共价化合物RQ3 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:R和Q为短周期中的两种元素,R元素原子的最外层电子数和次外层电子数之差的绝对值等于电子层数,如果R是第三周期元素,则R最外层电子数为5,则R是P元素,如果R是第二周期元素,则R最外层电子数为4,则R是C元素;Q元素的原子比R元素的原子多2个核外电子,则Q为Cl或O元素,
A.同一周期元素,原子半径随着原子序数增大而减小;
B.非金属元素之间易形成共价键,只含共价键的化合物为共价化合物;
C.正负电荷重心重合的分子为非极性分子;
D.如果R是P元素、Q是Cl元素,二者可以形成共价化合物PCl3.
A.同一周期元素,原子半径随着原子序数增大而减小;
B.非金属元素之间易形成共价键,只含共价键的化合物为共价化合物;
C.正负电荷重心重合的分子为非极性分子;
D.如果R是P元素、Q是Cl元素,二者可以形成共价化合物PCl3.
解答:
解:R和Q为短周期中的两种元素,R元素原子的最外层电子数和次外层电子数之差的绝对值等于电子层数,如果R是第三周期元素,则R最外层电子数为5,则R是P元素,如果R是第二周期元素,则R最外层电子数为4,则R是C元素;Q元素的原子比R元素的原子多2个核外电子,则Q为Cl或O元素,
A.同一周期元素,原子半径随着原子序数增大而减小,R、Q属于同一周期元素,且Q原子序数大于R,所以原子半径R>Q,故A正确;
B.如果R是P元素、Q是Cl元素,二者可以形成化合物PCl3或PCl5,如果R是C元素、Q是O元素,二者可以形成化合物CO或CO2,这几种物质中都只含共价键,属于共价化合物,故B错误;
C.如果R是C元素、Q是O元素,二者可以形成化合物CO2,二氧化碳属于非极性分子,故C正确;
D.如果R是P元素、Q是Cl元素,二者可以形成共价化合物PCl3,故D正确;
故选B.
A.同一周期元素,原子半径随着原子序数增大而减小,R、Q属于同一周期元素,且Q原子序数大于R,所以原子半径R>Q,故A正确;
B.如果R是P元素、Q是Cl元素,二者可以形成化合物PCl3或PCl5,如果R是C元素、Q是O元素,二者可以形成化合物CO或CO2,这几种物质中都只含共价键,属于共价化合物,故B错误;
C.如果R是C元素、Q是O元素,二者可以形成化合物CO2,二氧化碳属于非极性分子,故C正确;
D.如果R是P元素、Q是Cl元素,二者可以形成共价化合物PCl3,故D正确;
故选B.
点评:本题考查位置结构性质相互关系及应用,侧重考查学生发散思维能力,明确原子结构、物质结构是解本题关键,注意P和Cl元素能形成两种氯化物.

练习册系列答案
相关题目
下面关于Na2CO3和NaHCO3性质的叙述,不正确的是( )
| A、在水中的溶解度:碳酸钠>碳酸氢钠 |
| B、热稳定性:碳酸钠>碳酸氢钠 |
| C、溶液酸碱性:物质的量浓度相同时,Na2CO3溶液pH小于NaHCO3溶液的pH |
| D、等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,消耗HCl的量前者多 |
下列离子组在无色溶液中可以大量共存的是( )
| A、Na+、Cu2+、Cl-、NO3- |
| B、HCO3-、Na+、OH-、SO42- |
| C、H+、K+、CO32-、Cl- |
| D、H+、NO3-、Ca2+、Mg2+ |

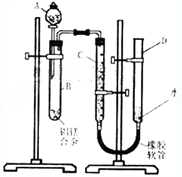 某学习小组用如图装置测定铝美合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图装置测定铝美合金中铝的质量分数和铝的相对原子质量.