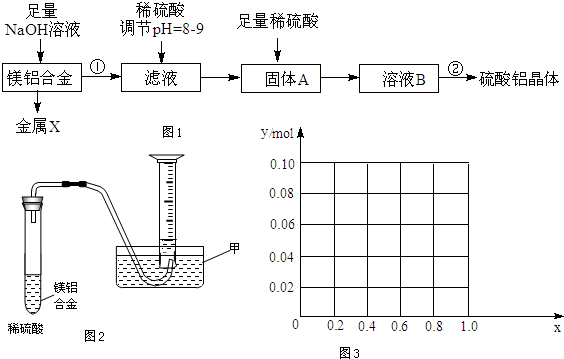
题目内容
3.合成氨工业对国民经济和社会发展具有重要的意义.其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越小.
(2)某温度下,若把1mol N2与3mol H2置于体积为1L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为$\frac{1}{3}$,则该温度下反应的K的计算式=$\frac{1^2}{0.5×1.5^3}$(用分数表示).能说明该反应达到化学平衡状态的是bd(填字母).
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
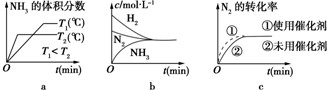
(3)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)ac.
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3mol H2,此时两容器的体积相等.在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ.则:a<b(填“>”、“=”或“<”,下同),Q1<Q2,Q1<92.4.
分析 (1)①根据化学平衡常数概念列表达式;②反应为放热反应,升温反应逆向移动,k变小;
(2)根据三段式和k的表达式可得;化学反应达到平衡状态时,正逆反应速率相等,各组分浓度保持不变,据此分析;
(3)a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动;
b.平衡时浓度不一定相等;
c.使用催化剂加快反应速率,对平衡无影响;
(4)恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,
而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动.
解答 解:(1)①根据化学平衡常数概念列表达式k=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$
②该反应是放热反应,温度越高,反应越逆向进行,K越小,故答案为:小;
(2)设反应氮气为x,根据三段式:
N2(g)+3H2(g)?2NH3(g)
起始浓度:1 3 0
转化浓度:x 3x 2x
平衡浓度:1-x 3.3x 2x
混合气体中氨的体积分数为$\frac{1}{3}$,有$\frac{2x}{1-x+3-3x+2x}$=$\frac{1}{3}$,解得x=0.5,则k=$\frac{1^2}{0.5×1.5^3}$;
a.容器体积不变,气体质量不变,所以容器内的密度始终保持不变,故a不选;
b.容器体积不变,反应前后气体物质的量不同,所以容器内压强保持不变说明反应达到平衡状态,故b选;
c.v正(N2)=2v逆(NH3),不符合化学计量数之比,故c不选;
d.混合气体中c(NH3)不变,说明各组分浓度都不变,反应达到平衡状态,故d选;
故答案为:$\frac{1^2}{0.5×1.5^3}$;bd;
(3)a.先出现拐点的先达到平衡,则T2大,温度高,平衡逆向移动,与图象一致,故a正确;
b.平衡时浓度不一定相等,平衡浓度取决起始浓度和转化率,图象表示错误,故b错误;
c.使用催化剂加快反应速率,对平衡无影响,平衡时物质的浓度不变,与图象一致,故c正确;
故答案为:ac;
(4)恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ,而恒压密闭容器B,均充入1mol N2和3molH2,反应发生后总物质的量减少,由pV=nRT可知,相对于A来说,相当于B加压,则平衡正向移动,氨气的体积分数变大,所以a<b,B中放出的热量对,则Q1<Q2,热化学方程式中反应热为完全反应放出的热量,而A中不能完全转化,放出的热量少,则Q1<92.4;
故答案为:<;<;<.
点评 本题考查较综合,涉及化学平衡的计算、影响反应速率及平衡的因素、平衡的判定、热化学反应方程式,化学平衡图象等,注重高考常考查点的考查,注意图象的分析,题目难度中等.

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案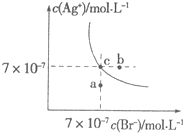 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 | |
| C. | 图中a点对应的是AgBr的不饱和溶液 | |
| D. | 向组成为c点的溶液中加入等体积的0.1 mol/L的氯化钠溶液,可产生AgCl沉淀 |
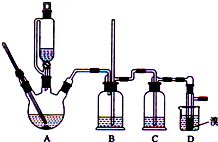 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是D;(填正确选项前的字母)
A.引发反应 B.加快反应速度 C.防止乙醇挥发 D.减少副产物乙醚生成
(2)在装置C中应加入C,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
A.水 B.浓硫酸 C.氢氧化钠溶液 D.饱和碳酸氢钠溶液
(3)判断该制备实验中各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗(填仪器名)中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用B洗涤除去;(填正确选项前的字母)
A.水 B.氢氧化钠溶液 C.碘化钠溶液 D.乙醇
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是冷却,避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| A. | 恒温恒容,充入NO2气体,其转化率增大 | |
| B. | 加压,平衡向逆反应方向移动,混合气体颜色变深 | |
| C. | 若平衡常数增大,则可能是升高了温度或减小了体系的压强 | |
| D. | 当2v正(NO)=v逆(O2)时,反应达到化学平衡状态 |
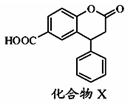
| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1mol化合物X最多能与7molH2反应 |