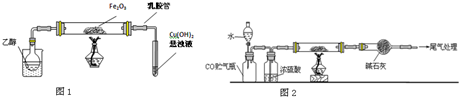
题目内容
 某课外小组模拟工业流程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护).
某课外小组模拟工业流程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护).(1)分别写出工业上用氨气制取NO及实验室用浓硝酸制取NO2的化学方程式:
(2)连接好该装置后,首先进行的操作是:
(3)通入a气体的目的是:
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是:
已知:NO2可被NaOH溶液完全吸收,而NO不能被吸收,但当NO2与NO按一定的比例混合时,可被NaOH溶液完全吸收,则此时NO2与NO的物质的量比例关系是:
(5)用N2O4代替NO2与水和a气体反应可生成硝酸,此反应的化学方程式是:
考点:实验装置综合,硝酸的化学性质
专题:实验题,元素及其化合物
分析:(1)工业上用氨气的催化氧化制取NO,铜与浓硝酸反应生成硝酸铜和二氧化氮与水;
(2)连接好装置后先要检验装置的气密性;
(3)通入氧气可以提高二氧化氮的转化率;
(4)根据元素守恒和得失电子守恒分析;
(5)N2O4为NO2偶合反应得到的,故与NO2具有相似的性质,依据NO2与水和氧气的反应书写即可.
(2)连接好装置后先要检验装置的气密性;
(3)通入氧气可以提高二氧化氮的转化率;
(4)根据元素守恒和得失电子守恒分析;
(5)N2O4为NO2偶合反应得到的,故与NO2具有相似的性质,依据NO2与水和氧气的反应书写即可.
解答:
解:(1)工业上用氨气的催化氧化制取NO,反应方程式为:4NH3+5O2
4NO+6H2O,铜与浓硝酸反应生成硝酸铜、二氧化氮和水,反应方程式为:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,
故答案为:4NH3+5O2
4NO+6H2O,Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;
(2)连接好装置后先要检验装置的气密性,当装置气密性良好才能进一步进行实验,
故答案为:检验装置的气密性;
(3)二氧化氮通入水中会生成硝酸和一氧化氮,再通氧气可以使一氧化氮转化为二氧化氮从而提高了NO2的转化率,
故答案为:提高NO2的转化率;
(4)根据元素守恒和得失电子守恒分析,2NO2和水反应生成硝酸,硝酸与碳酸钠反应生成硝酸钠和二氧化碳,
其反应方程为:2NO2+2Na2CO3+H2O=NaNO2+NaNO3+2NaHCO3,NO2与NO按一定的比例混合时,可被NaOH溶液完全吸收,化学反应方程式为:NO2+NO+NaOH=NaNO2+H2O,由于NO不溶,故NO2应至少等于NO,
故答案为:2、2、1、NaNO3、2NaHCO3;
≥1;
(5)N2O4类似NO2,NO2与水和氧气反应生成硝酸,故N2O4可以发生反应:2N2O4+O2+2H2O=4HNO3,故答案为:2N2O4+O2+2H2O=4HNO3.
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
(2)连接好装置后先要检验装置的气密性,当装置气密性良好才能进一步进行实验,
故答案为:检验装置的气密性;
(3)二氧化氮通入水中会生成硝酸和一氧化氮,再通氧气可以使一氧化氮转化为二氧化氮从而提高了NO2的转化率,
故答案为:提高NO2的转化率;
(4)根据元素守恒和得失电子守恒分析,2NO2和水反应生成硝酸,硝酸与碳酸钠反应生成硝酸钠和二氧化碳,
其反应方程为:2NO2+2Na2CO3+H2O=NaNO2+NaNO3+2NaHCO3,NO2与NO按一定的比例混合时,可被NaOH溶液完全吸收,化学反应方程式为:NO2+NO+NaOH=NaNO2+H2O,由于NO不溶,故NO2应至少等于NO,
故答案为:2、2、1、NaNO3、2NaHCO3;
| c(NO2) |
| c(NO) |
(5)N2O4类似NO2,NO2与水和氧气反应生成硝酸,故N2O4可以发生反应:2N2O4+O2+2H2O=4HNO3,故答案为:2N2O4+O2+2H2O=4HNO3.
点评:本题考查了硝酸的制备,侧重于氨的催化氧化、基本实验操作、化学方程式的书写的考查,题目难度一般.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案
相关题目
向淀粉溶液中加入少量稀硫酸,加热使之发生水解,为了测定水解的程度,所需的下列试剂是:①NaOH溶液;②银氨溶液;③新制Cu(OH)2悬浊液; ④碘水;⑤BaCl2溶液( )
| A、①⑤ | B、②④ |
| C、①③④ | D、①③⑤ |
如图所示的装置最适宜于干燥、收集的气体是( )


| A、NO |
| B、HC1 |
| C、NO2 |
| D、NH3 |