题目内容
随着环保意识的增强,清洁能源越来越受人们关注.
(1)氢能在21世纪有可能在世界能源舞台上成为一种举足轻重的二次能源.
①利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol?L-1;c(H2O)=8.5mol?L-1;c(CO)=2.0mol?L-1;c(H2)=2.0mol?L-1,则此时正逆反应速率的关系是v正 v逆.(填“>”、“<”或“=”)
②实验室用Zn和稀硫酸制取H2,该反应进行时溶液中水的电离平衡 移动(填“向左”、“向右”或“不”);若加入少量下列固体试剂中的 ,产生H2的速率将增大.
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO4
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g),分析该反应并回答下列问题:
①下列各项中,能说明该反应已达到平衡的是 .
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1mol CO,同时生成l mol CH3OH
②如图1是该反应在不同温度下CO的转化率随时间变化的曲线.T1和T2温度下的平衡常数大小关系是K1 K2.(填“>”、“<”或“=”)
③已知甲醇燃料电池的工作原理如图2所示.该电池工作时,b口通入的物质为 ,该电池正极的电极反应式为: ,工作一段时间后,当6.4g甲醇(CH3OH)完全反应生成CO2时,有 mol电子发生转移.
(1)氢能在21世纪有可能在世界能源舞台上成为一种举足轻重的二次能源.
①利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol?L-1;c(H2O)=8.5mol?L-1;c(CO)=2.0mol?L-1;c(H2)=2.0mol?L-1,则此时正逆反应速率的关系是v正
②实验室用Zn和稀硫酸制取H2,该反应进行时溶液中水的电离平衡
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO4
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g),分析该反应并回答下列问题:
①下列各项中,能说明该反应已达到平衡的是
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1mol CO,同时生成l mol CH3OH
②如图1是该反应在不同温度下CO的转化率随时间变化的曲线.T1和T2温度下的平衡常数大小关系是K1

③已知甲醇燃料电池的工作原理如图2所示.该电池工作时,b口通入的物质为
考点:用化学平衡常数进行计算,原电池和电解池的工作原理,化学反应速率的影响因素,化学平衡状态的判断
专题:
分析:(1)①计算该浓度下的溶度积Qc,与平衡常数k=1比较,若Qc=1,处于平衡状态,若Qc>1,平衡向逆反应移动,若Qc<1,向正反应移动.
②实验室用Zn和稀硫酸制取H2,随反应进行溶液中氢离子浓度降低,水的电离平衡增大;增大氢离子的浓度、加热、形成原电池等可以加快反应速率.
(2)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变.
a.恒温、恒容条件下,随反应进行反应混合物的物质的量减小,体系压强减小,容器内的压强不发生变化,说明到达平衡.
b.CH3OH分解的速率和CH3OH生成的速率相等,正逆反应速率相等,反应达平衡状态.
c.各物质的浓度不变,说明到达平衡状态.
d.单位时间内消耗1mol CO,同时生成l mol CH3OH,都表示正反应速率,自始至终都按1:1进行.
②温度越高反应速率越快,到达平衡时间越短,故T1<T2,温度越高CO的转化率越小,升高温度平衡向逆反应移动.
③由质子的定向移动可知左侧电极为燃料电池的负极,右侧电极为燃料电池的正极,负极发生氧化反应,甲醇在负极放电,正极反应还原反应,氧气在正极放电,负极电极反应式为CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+,正极反应式为O2+4e-+4H+=2H2O.6.4g甲醇(CH3OH)的物质的量为
=0.2mol,根据电极反应式计算转移电子的物质的量.
②实验室用Zn和稀硫酸制取H2,随反应进行溶液中氢离子浓度降低,水的电离平衡增大;增大氢离子的浓度、加热、形成原电池等可以加快反应速率.
(2)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变.
a.恒温、恒容条件下,随反应进行反应混合物的物质的量减小,体系压强减小,容器内的压强不发生变化,说明到达平衡.
b.CH3OH分解的速率和CH3OH生成的速率相等,正逆反应速率相等,反应达平衡状态.
c.各物质的浓度不变,说明到达平衡状态.
d.单位时间内消耗1mol CO,同时生成l mol CH3OH,都表示正反应速率,自始至终都按1:1进行.
②温度越高反应速率越快,到达平衡时间越短,故T1<T2,温度越高CO的转化率越小,升高温度平衡向逆反应移动.
③由质子的定向移动可知左侧电极为燃料电池的负极,右侧电极为燃料电池的正极,负极发生氧化反应,甲醇在负极放电,正极反应还原反应,氧气在正极放电,负极电极反应式为CH3OH(l)+H2O(l)-6e-=CO2(g)+6H+,正极反应式为O2+4e-+4H+=2H2O.6.4g甲醇(CH3OH)的物质的量为
| 6.4g |
| 32g/mol |
解答:
解:(1)①浓度商Qc=
=0.6<1,所以平衡向正反应移动,即v正>v逆,故选:>;
②实验室用Zn和稀硫酸制取H2,随反应进行溶液中氢离子浓度降低,水的电离平衡增大,向右移动;
a.加入NaNO3,氢离子浓度不变,不能增大氢气的生成速率,故a错误;
b.加入CuSO4,形成原电池,加快氢气的生成速率,故b正确;
c.加入Na2SO4,氢离子浓度不变,不能增大氢气的生成速率,故c错误;
d.加入NaHSO4,NaHSO4电离出氢离子,氢离子浓度增大,氢气的生成速率加快,故d正确;
故答案为:向右;bd;
(2)①化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变.
a.恒温、恒容条件下,随反应进行反应混合物的物质的量减小,体系压强减小,容器内的压强不发生变化,说明到达平衡,故a正确;
b.CH3OH分解的速率和CH3OH生成的速率相等,正逆反应速率相等,反应达平衡状态,故b正确;
c.CO、H2和CH3OH的浓度保持不变,说明到达平衡状态,故c正确;
d.单位时间内消耗1mol CO,同时生成l mol CH3OH,都表示正反应速率,自始至终都按1:1进行,故d错误;
故选:abc;
②温度越高反应速率越快,到达平衡时间越短,故T1<T2,温度越高CO的转化率越小,升高温度平衡向逆反应移动,温度平衡常数降低,温度越高平衡常数越小,即K1>K2,故答案为:>;
③由质子的定向移动可知左侧电极为燃料电池的负极,右侧电极为燃料电池的正极,负极发生氧化反应,甲醇在负极放电,故b通入CH3OH;正极反应还原反应,氧气在正极放电,正极反应式为O2+4e-+4H+=2H2O;6.4g甲醇(CH3OH)的物质的量为
=0.2mol,由负极电极反应式为CH3OH+H2O-6e-=CO2+6H+可知转移电子的物质的量为0.2mol×6=1.2mol,故答案为:CH3OH;O2+4e-+4H+=2H2O;1.2.
| 23×2 |
| 3×8.5 |
②实验室用Zn和稀硫酸制取H2,随反应进行溶液中氢离子浓度降低,水的电离平衡增大,向右移动;
a.加入NaNO3,氢离子浓度不变,不能增大氢气的生成速率,故a错误;
b.加入CuSO4,形成原电池,加快氢气的生成速率,故b正确;
c.加入Na2SO4,氢离子浓度不变,不能增大氢气的生成速率,故c错误;
d.加入NaHSO4,NaHSO4电离出氢离子,氢离子浓度增大,氢气的生成速率加快,故d正确;
故答案为:向右;bd;
(2)①化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变.
a.恒温、恒容条件下,随反应进行反应混合物的物质的量减小,体系压强减小,容器内的压强不发生变化,说明到达平衡,故a正确;
b.CH3OH分解的速率和CH3OH生成的速率相等,正逆反应速率相等,反应达平衡状态,故b正确;
c.CO、H2和CH3OH的浓度保持不变,说明到达平衡状态,故c正确;
d.单位时间内消耗1mol CO,同时生成l mol CH3OH,都表示正反应速率,自始至终都按1:1进行,故d错误;
故选:abc;
②温度越高反应速率越快,到达平衡时间越短,故T1<T2,温度越高CO的转化率越小,升高温度平衡向逆反应移动,温度平衡常数降低,温度越高平衡常数越小,即K1>K2,故答案为:>;
③由质子的定向移动可知左侧电极为燃料电池的负极,右侧电极为燃料电池的正极,负极发生氧化反应,甲醇在负极放电,故b通入CH3OH;正极反应还原反应,氧气在正极放电,正极反应式为O2+4e-+4H+=2H2O;6.4g甲醇(CH3OH)的物质的量为
| 6.4g |
| 32g/mol |
点评:本题考查化学平衡判断与移动、化学平衡常数、影响化学反应速率的因素、原电池等,综合性较大,难度中等,是对知识的综合利用,加强对基础知识理解掌握.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
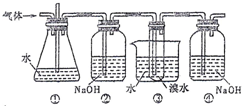 如图是用实验室制得的乙烯(C2H5OH
如图是用实验室制得的乙烯(C2H5OH | 浓硫酸 |
| 170℃ |
| A、装置①和装置③中都盛有水,其作用相同 |
| B、装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同 |
| C、产物可用分液的方法进行分离,1,2-二溴乙烷应从分液漏斗的上口倒出 |
| D、制备乙烯和生成1,2-二溴乙烷的反应类型分别是消去反应和加成反应 |
 A─E五种元素中,除A、B外其他均为短周期元素,它们的性质或原子结构如下表:
A─E五种元素中,除A、B外其他均为短周期元素,它们的性质或原子结构如下表: 某课外小组模拟工业流程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护).
某课外小组模拟工业流程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护).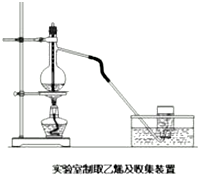 实验室常用下面装置制备乙稀,请回答下列问题:
实验室常用下面装置制备乙稀,请回答下列问题: