题目内容
1.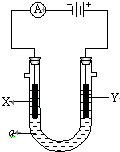 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导与直流电源相连.请回答以下问题:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则①电解池中X极上的电极反应式为2H2O+2e-═2OH-+H2↑.在X极附近观察到的现象是有气泡,溶液变红.
②Y电极上的电极反应式为2Cl--2e-═Cl2↑,检验该电极反应产物的方法是把湿润的淀粉KI试纸放在Y极附近,试纸变蓝,说明Y极产物为Cl2.
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是纯铜,电极反应式是Cu2++2e-═Cu.
②Y电极的材料是粗铜,电极反应式是Cu-2e-═Cu2+.
(3)如要用电解方法在铁上镀铜,电解液a选用CuSO4溶液
①X电极的材料是Fe,电极反应式是Cu2++2e-═Cu.
②Y电极的材料是纯铜,电极反应式是Cu-2e-═Cu2+.
(说明:杂质发生的电极反应不必写出)
分析 (1)若X、Y都是惰性电极,a是饱和NaCl溶液,X连接电源负极,为阴极,Y连接电源正极,为阳极.
①阴极发生还原反应,水在阴极放电生成氢气与氢氧根离子,酚酞遇碱变红色;
②阳极发生氧化反应,氯离子在阳极失去多少生成氯气,氯气可以用湿润的淀粉碘化钾试纸检验;
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜、阴极是纯铜,则X电极是纯铜、Y电极是粗铜,阳极发生氧化反应,Cu失去电子,阴极上发生还原反应,铜离子电子生成Cu;
(3)如要用电解方法在铁上镀铜,电解液a选用CuSO4溶液,Fe为阴极、Cu为阳极,阳极发生氧化反应,Cu失去电子,阴极上发生还原反应,铜离子电子生成Cu.
解答 解:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,X连接电源负极,为阴极,Y连接电源正极,为阳极.
①阴极发生还原反应,水在阴极放电生成氢气与氢氧根离子,电极反应式为:2H2O+2e-═2OH-+H2↑,反应生成氢气与碱,在X极附近观察到的现象是:有气泡,溶液变红,
故答案为:2H2O+2e-═2OH-+H2↑;有气泡,溶液变红;
②阳极发生氧化反应,氯离子在阳极失去多少生成氯气,电极反应式为:2Cl--2e-═Cl2↑,检验氯气的方法为:把湿润的淀粉KI试纸放在Y极附近,试纸变蓝,说明Y极产物为Cl2,
故答案为:2Cl--2e-═Cl2↑;把湿润的淀粉KI试纸放在Y极附近,试纸变蓝,说明Y极产物为Cl2;
(2)电解方法精炼粗铜,电解液a选用CuSO4溶液,粗铜做阳极,精铜做阴极.
①X为阴极,则X电极材料为纯铜,电极反应式为:Cu2++2e-═Cu,
故答案为:纯铜;Cu2++2e-═Cu;
②Y电极为电解池的阳极,所以Y电极的材料是粗铜,电极反应式为:Cu-2e-═Cu2+,
故答案为:粗铜;Cu-2e-═Cu2+;
(3)如要用电解方法在铁上镀铜,电解液a选用CuSO4溶液,Fe为阴极、Cu为阳极,阳极发生氧化反应,Cu失去电子,阴极上发生还原反应,铜离子电子生成Cu.
①X为阴极,则X电极材料为Fe,电极反应式为:Cu2++2e-═Cu,
故答案为:纯铜;Cu2++2e-═Cu;
②Y电极为电解池的阳极,所以Y电极的材料是纯铜,电极反应式为:Cu-2e-═Cu2+,
故答案为:纯铜;Cu-2e-═Cu2+.
点评 本题考查电解原理及应用,关键是判断两极,掌握离子放电顺序,理解电镀池构成条件,难度中等.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案| A. | 减少化石能源的使用,大力发展太阳能、风能等新能源 | |
| B. | 淘汰落后产能,将污染严重的企业从城市迁往农村 | |
| C. | 控制城市机动车持有量,实行机动车限号行驶 | |
| D. | 倡导绿色化学理念,努力实现“原子经济” |
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→B、A→C、D→E;其中广口瓶Ⅱ中的试剂为饱和食盐水.
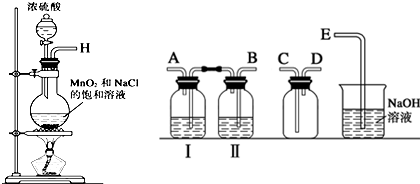
(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)实验室有一瓶密封不严的漂白粉样品,其中肯定存在CaCl2.请设计实验,探究该样品中除CaCl2外还含有的其他固体物质.
①提出合理假设.
假设1:该漂白粉未变质,还含有Ca(ClO)2
假设2:该漂白粉全部变质,还含有CaCO3;
假设3:该漂白粉部分变质,还含有Ca(ClO)2和CaCO3.
②设计实验方案,进行实验.请在下表中写出实验步骤、预期现象和结论.
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、品红溶液、1mol•L-1 HCl溶液、新制澄清石灰水.(提示:不必检验Ca2+和Cl-.)
| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 取少量上述漂白粉于试管中,先加入适量1mol•L-1盐酸溶解后,再把生成的气体通入新制澄清石灰水中. | 若澄清石灰水未见浑浊,则假设1成立; 若澄清石灰水变浑浊,则假设2或假设3成立. |
| 步骤2 | 已确定漂白粉变质,则另取少量上述漂白粉于试管中,先加入适量1mol•L-1 HCl溶液,再加入几滴品红溶液振荡. | 若品红溶液不褪色,则假设2成立; 若品红溶液褪色,则假设3成立. |
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B△H=+119kJ/mol,可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol | |
| D. | 在25℃、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则表示H2燃烧热的化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol |
| A. | 利用化学反应可实现12C到14C的转化 | |
| B. | 天然气、煤气大量泄漏遇到明火会爆炸 | |
| C. | 大量使用燃煤发电是形成雾霾的主要原因 | |
| D. | 晶体硅可用作半导体材料 |
