题目内容
12.把6.5g Zn放入足量盐酸溶液中完全反应,计算:(1)生成氢气的体积(标准状况);
(2)反应后溶液体积为200ml,问所得溶液的浓度.
分析 (1)根据n=$\frac{m}{M}$计算6.5g锌的物质的量;根据Zn+2HCl=ZnCl2+H2↑计算参加反应的氯化氢的物质的量,再根据V=nVm计算;
(2)根据c=$\frac{n}{V}$,进行计算求解.
解答 解:(1)6.5g锌的物质的量为$\frac{6.5g}{65g/mol}$=0.1mol,
令生成的氢气物质的量为xmol,则:
Zn+2HCl=ZnCl2+H2↑
1 1
0.1mol x
故x=$\frac{0.1mol×1}{1}$=0.1mol,
所以生成氢气的体积为0.1mol×22.4L/mol=2.24L,
答:标况下生成氢气的体积为2.24L;
(2)令生成的氯化锌物质的量为ymol,则:
Zn+2HCl=ZnCl2+H2↑
1 1
0.1mol y
故y=$\frac{0.1mol×1}{1}$=0.1mol,所以c=$\frac{n}{V}$=,
反应后溶液体积为200ml,所得溶液的浓度$\frac{0.1}{0.2}$=0.5mol/L,
答:所得溶液的浓度为0.5mol/L.
点评 本题考查根据方程式的有关计算,比较基础,旨在考查学生对基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.某有机物甲经氧化后得到乙(C2H3O2Cl),而甲经水解可得到丙.1mol丙和2mol乙反应可得到一种含氯的酯(C6H8O4Cl2).以此推断甲的结构简式为( )
| A. | Cl-CH2-CH2-OH | B. | Cl-CH2-CHO | C. | HCOOCH2Cl | D. | HO-CH2-CH2OH |
7.一定条件下,2SO2(g)+O2(g)?2SO3(g)△H<0.下列有关叙述正确的是( )
| A. | 升高温度,v(正)变大,v(逆)变小 | |
| B. | 恒温恒容,平衡前后混合气体的密度保持不变 | |
| C. | 恒温恒压,充入N2,平衡不移动 | |
| D. | 恒温恒容,充入O2,O2的转化率升高 |
2.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA | |
| B. | 标准状况下电解硫酸铜溶液时,阳极每生成气体3.36 L,转移电子数为0.6NA | |
| C. | 标准状况下,30gNO和16gO2混合所生成的气体分子数为NA | |
| D. | 1mol氯气参加氧化还原反应,转移的电子数一定为2NA |
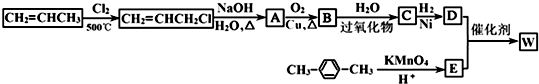
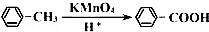
 .
.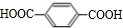 →
→ +2H2O.
+2H2O.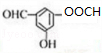 .
.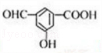 .
.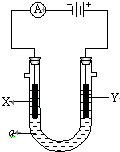 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导与直流电源相连.请回答以下问题: