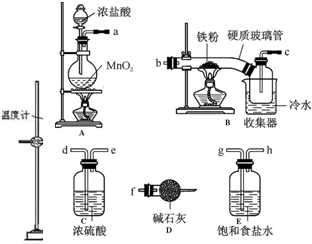
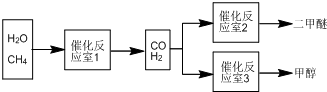
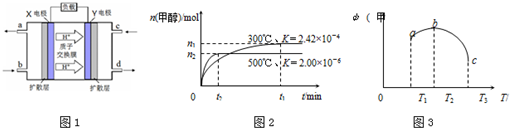
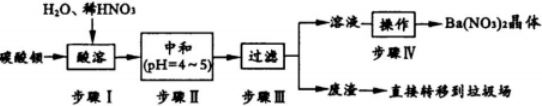
题目内容
19.通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.现给出化学键的键能(见表):| 化学键 | H-H | N三N | N-H |
| 键能/(kJ•mol-1) | 436 | 945.6 | 391 |
| A. | +192.4 kJ•mol-1 | B. | +92.4kJ•mol-1 | C. | -92.4kJ•mol-1 | D. | -192.4kJ•mol-1 |
分析 焓变等于反应物中键能之和减去生成物中键能之和,以此来解答.
解答 解:由表格中键能及N2(g)+3H2(g)═2NH3(g)可知,该反应的反应热△H=945.6kJ/mol+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ•mol-1,
故选C.
点评 本题考查反应热与焓变,为高频考点,把握键能与焓变的关系为解答的关键,侧重分析与计算能力的考查,注意判断物质中的化学键数目,题目难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
9.用纤维素为主要原料制备乙酸乙酯的路线如下:
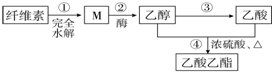
下列说法正确的是( )

下列说法正确的是( )
| A. | ③和④都发生了氧化还原反应 | |
| B. | M虽然分子结构中无醛基,但仍然可以发生银镜反应 | |
| C. | 步骤②,1molM完全反应可以生成3mol乙醇 | |
| D. | 若用淀粉替代纤维素,一定条件下也能按照此路线制备乙酸乙酯 |
4.下列对H2(g)+Cl2(g)=2HCl(g)△H(298K)=-184.6kJ•mol-1的叙述正确的是( )
| A. | 1分子H2和Cl2反应,放出热量184.6 kJ | |
| B. | 1 mol H2(g)完全反应生成2 mol HCl(g),放出的热量为184.6 kJ | |
| C. | 在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)放出的热量为184.6 kJ | |
| D. | 在101 kPa、25℃的条件下,1 mol H2(g)和1 mol Cl2(g)完全反应生成2 mol HCl(g)吸收的热量为184.6 kJ |
9.下列溶液中物质的量浓度为1mol•L-1的是( )
| A. | 将20gNaOH溶解在500mL水中 | |
| B. | 将22.4L HCl气体溶于水配成1 L溶液 | |
| C. | 将1 L 10 mol•L-1浓盐酸加入9L水中 | |
| D. | 将10gNaOH溶解在少量水中,恢复至室温,再加蒸馏水直到溶液体积为250mL |