题目内容
19.下列说法正确的是( )| A. | 基态时,相同周期的两种元素原子所含的能级和能层是一样的 | |
| B. | 基态时,稀有气体元素原子的价层电子数都为8 | |
| C. | 基态时,同种元素的原子和离子的轨道排布式一样 | |
| D. | 非金属元素原子的d轨道一定不填充电子或填满电子 |
分析 A、基态时,相同周期的两种元素原子所含的能层是一样的,但能级不一定相同;
B、稀有气体氦价电子数为2;
C、同种元素的原子和离子核外电子数不同,所以轨道排布式不一样;
D、非金属元素位于s区和p区,位于s区d轨道不填充电子,而位于p区d轨道填满电子.
解答 解:A、基态时,相同周期的两种元素原子所含的能层是一样的,但能级不一定相同,如第四周期的钙与过渡元素能级不同,过渡元素出现了d能级,故A错误;
B、稀有气体氦价电子数为2,而不是8,故B错误;
C、同种元素的原子和离子核外电子数不同,所以轨道排布式不一样,故C错误;
D、非金属元素位于s区和p区,位于s区d轨道不填充电子,而位于p区d轨道填满电子,故D正确;
故选D.
点评 本题考查结构与位置关系、元素周期表,难度不大,注意把握元素周期表的结构,基态时原子和离子核外电子数不同所以轨道排布不同.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列反应的离子方程式书写正确的是( )
| A. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| B. | NaHCO3溶液中加入过量的 Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 氯化铝溶液中加入过量氨水 Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S↑ |
7.室温下进行相关实验.下列结论正确的是( )
| A. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)═c(HCO3-)+c(CO32-) | |
| B. | 向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)>c(Cl-) | |
| C. | 向浓度为0.1mol/LNaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH<13 | |
| D. | 将0.1molAgCl投入到100mL0.1mol/LNaCl溶液中:c(Ag+)=c(Cl-) |
11.石油被称为“工业的血液”,以石油为原料不仅可以得到各种燃料油,还可以获得多种有机化工原料.请回答下列问题:
(1)将石蜡油与碎瓷片混合共热,产生的混合气体冷却至室温后,其成分如下:
将2mol该混合气体通入足量的溴的四氯化碳溶液中,消耗Br2的物质的量为1mol.
(2)经发现,石蜡油与碎瓷片混合共热的产物中,除气态烃CH4、C2H6、CH2═CH2外,还有另一种液态烃M生成.0.2mol该液态烃在O2中完全燃烧时,得到的两种生成物的物质的量均为1.2mol.
①烃M的分子式为C6H12.
②烃N是烃M的一种同分异构体,其结构中含有4个甲基,则烃N的结构简式为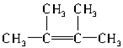 .
.
③烃N中一定处于同一平面的碳原子数为6.
④写出烃N发生自身加聚反应的化学方程式 .
.
(1)将石蜡油与碎瓷片混合共热,产生的混合气体冷却至室温后,其成分如下:
| 物质 | CH4 | CH3-CH3 | CH2═CH2 |
| 物质的量分数 | 20% | 30% | 50% |
(2)经发现,石蜡油与碎瓷片混合共热的产物中,除气态烃CH4、C2H6、CH2═CH2外,还有另一种液态烃M生成.0.2mol该液态烃在O2中完全燃烧时,得到的两种生成物的物质的量均为1.2mol.
①烃M的分子式为C6H12.
②烃N是烃M的一种同分异构体,其结构中含有4个甲基,则烃N的结构简式为
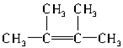 .
.③烃N中一定处于同一平面的碳原子数为6.
④写出烃N发生自身加聚反应的化学方程式
 .
.
12.下列说法正确的是( )
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 吸热反应不加热就不会发生 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 |
 .
.