题目内容
15. 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用.铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O.
负极反应式为Pb+SO42--2e-=PbSO4.
正极反应式为PbO2+SO42-+4H++2e-=PbSO4+2H2O.
(2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为2Fe3++Cu=2Fe2++Cu2+,若将此反应设计成原电池,则负极所用电极材料为Cu,正极反应式为2Fe3++2e-=2Fe2+.
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为B.
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式:Al+4OH--3e-=AlO2-+2H2O.
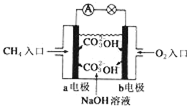
(4)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是a(填“a”或“b”),该极的电极反应式是:CH4+10OH--8e-=CO32-+7H2O.
②电池工作一段时间后电解质溶液的pH减小(填“增大”、“减小”或“不变”).
分析 (1)依据铅蓄电池的电池总反应式分析,放电时,Pb在负极失电子发生氧化反应,PbO2在正极得到电子发生还原反应生成硫酸铅;
(2)Fe3+有强氧化性,能把金属铜氧化成铜离子;根据电池反应式设计原电池,Cu失电子作负极,Fe3+在正极上得电子生成Fe2+;
(3)铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,根据负极金属单质上电子来判断;碱性条件下,Al失电子生成偏铝酸根离子;
(4)①燃料电池中通入燃料的一极为原电池的负极,通入氧气的一极为原电池的正极,负极上是燃料发生失电子的氧化反应;
②根据燃料电池的总反应方程式判断pH的变化.
解答 解:(1)铅蓄电池的电池总反应式为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,依据反应的总电池反应,反应中Pb元素化合价升高的在负极失电子发生氧化反应,其电极反应为:Pb+SO42--2e-=PbSO4,PbO2中元素化合价降低的是在正极得到电子发生还原反应生成硫酸铅,电极反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O,
故答案为:Pb+SO42--2e-=PbSO4;PbO2+SO42-+4H++2e-=PbSO4+2H2O;
(2)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,设计成原电池时,Cu在负极上发生氧化反应,正极上三价铁离子得电子发生还原反应,其正极上的电极反应式为2Fe3++2e-=2Fe2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;Cu;2Fe3++2e-=2Fe2+;
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,铝钝化,所以Cu失电子作负极,Cu-2e-=Cu2+,一组插入烧碱溶液中,Cu与氢氧化钠不反应,Al失电子作负极,碱性条件下,Al失电子生成偏铝酸根离子,其电极反应为:Al+4OH--3e-=AlO2-+2H2O;
故答案为:B;Al+4OH--3e-=AlO2-+2H2O;
(4)①碱性甲烷燃料电池中通入甲烷的一极a为原电池的负极,该极上是燃料发生失电子的氧化反应,即CH4+10OH--8e-=CO32-+7H2O,
故答案为:a;CH4+10OH--8e-=CO32-+7H2O;
②已知氢氧燃料电池的总反应为:2H2+O2=2H2O,电池工作一段时间后,生成水使溶液体积增大,则硫酸的浓度减小,故答案为:减小.
点评 本题综合考查了原电池的内容,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写,题目难度中等.

| A. | Fe3+、K+、Ag+、NO3-、 | B. | Na+、K+、CO32-、C1- | ||
| C. | NH4+、Al3+、Cl-、NO3- | D. | Mg2+、Na+、CO32-、SO42- |
| A. | 92 | B. | 143 | C. | 235 | D. | 327 |
| A. | 1.0 mol•L-1的KNO3溶液中:Fe2+、H+、Cl-、I- | |
| B. | 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN- | |
| C. | 常温下,在c(H+)/c(OH-)=1×1012的溶液:NH4+、Mg2+、C1-、K+ | |
| D. | 水电离的c(H+)=1×10-13 mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
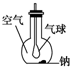 如图所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到钠表面变暗,气球膨胀,发生反应的化学方程式为4Na+O2═2Na2O.
如图所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到钠表面变暗,气球膨胀,发生反应的化学方程式为4Na+O2═2Na2O.
 .
.