题目内容
13.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热.已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量.(1)反应的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63KJ/mol
(2)此反应用于火箭推进,除释放大量热和快速产生气体外,还有一个优点是生成物为氮气和水,不污染空气.
分析 (1)反应方程式为:N2H4+2H2O2=N2+4H2O,根据0.4mol液态与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ,计算1mol液态肼的热量,标注物质聚集状态和对应反应的焓变进而写出热化学方程式;
(2)依据反应N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)的产物是氮气和水分析该反应的优点.
解答 解:(1)0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量2.5×256.652KJ=641.63KJ,则热化学方程式为:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.63kJ•mol-1,
故答案为:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.63kJ•mol-1;
(2)除释放大量热和快速产生大量气体外,生成物为氮气和水,不污染空气,故答案为:生成物为氮气和水,不污染空气;
点评 本题结合化学能源考查了热化学方程式的书写,难度不大,根据课本知识即可完成.

练习册系列答案
相关题目
1.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 一定条件下,1 mol N2与足量H2反应生成NH3,转移电子6NA | |
| C. | 1L0.1 mol•L-1(NH4)2SO4溶液中含有0.2NA个NH4+ | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
2.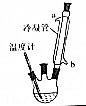 肉桂酸乙酯具有草莓香味,用于配置香水、香精和人造精油.实验室制备肉桂酸乙酯的反应、装置示意图和有关数据如下:
肉桂酸乙酯具有草莓香味,用于配置香水、香精和人造精油.实验室制备肉桂酸乙酯的反应、装置示意图和有关数据如下:
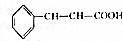 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$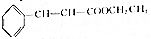 +H2O
+H2O
实验步骤:
制取:①在三颈烧瓶中加入20.0g肉桂酸、50.0g乙醇、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热至约75℃,回流12h.②进行蒸馏.③进行减压蒸馏,精制.最终制得17.6g肉桂酸乙酯.
(1)步骤①中冷凝管的作用是冷凝回流.
(2)步骤②中进行蒸馏的目的是除去乙醇,制备过程中需要控制温度在75℃,常采用的方法是水浴加热.
(3)本实验中加入过量乙醇的目的是提高肉桂酸的转化率.
(4)若要分离肉桂酸乙酯和水的混合物,常采用的分离方法是分液,分离过程中需要用到的玻璃仪器有分液漏斗.下图给出蒸馏操作中,仪器选择及安装都正确的是D(填字母序号).

(5)本实验中肉桂酸的利用率是74%.
 肉桂酸乙酯具有草莓香味,用于配置香水、香精和人造精油.实验室制备肉桂酸乙酯的反应、装置示意图和有关数据如下:
肉桂酸乙酯具有草莓香味,用于配置香水、香精和人造精油.实验室制备肉桂酸乙酯的反应、装置示意图和有关数据如下: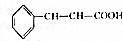 +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$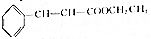 +H2O
+H2O | 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | 78.3 | 与水互溶 |
| 肉桂酸 | 148 | 1.245 | 300 | 微溶于水 |
| 肉桂酸乙酯 | 176 | 1.049 | 270 | 不溶于水 |
制取:①在三颈烧瓶中加入20.0g肉桂酸、50.0g乙醇、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热至约75℃,回流12h.②进行蒸馏.③进行减压蒸馏,精制.最终制得17.6g肉桂酸乙酯.
(1)步骤①中冷凝管的作用是冷凝回流.
(2)步骤②中进行蒸馏的目的是除去乙醇,制备过程中需要控制温度在75℃,常采用的方法是水浴加热.
(3)本实验中加入过量乙醇的目的是提高肉桂酸的转化率.
(4)若要分离肉桂酸乙酯和水的混合物,常采用的分离方法是分液,分离过程中需要用到的玻璃仪器有分液漏斗.下图给出蒸馏操作中,仪器选择及安装都正确的是D(填字母序号).

(5)本实验中肉桂酸的利用率是74%.
1.短周期主族元素A、B、C、D、E的原子序数依次递增,A的单质在常温下呈气态,D元素的单质既能与盐酸反应也能与NaOH溶液反应,B、C、E原子的最外层电子数之和为13,E原子的最外层电子数是B原子内层电子数的3倍或是C原子最外层电子数的3倍.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(B)<r(C)<r(D) | |
| B. | 元素B、E的最高价氧化物的水化物都是强酸 | |
| C. | C、D的氧化物都能与氢氧化钠反应 | |
| D. | 工业上常用电解元素C、D的氯化物来制取它们的单质 |
5.下列实验操作中错误的是( )
| A. | 食盐水蒸发结晶,蒸发皿中出现大量晶体时停止加热,利用余热使溶液蒸干 | |
| B. | 金属钠着火,立即用沙土扑灭 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 实验室制取蒸馏水的装置中,冷水从冷凝管的上口进,下口出 |
2.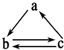 下表所列各组物质中,物质之间不能通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间不能通过一步反应就能实现如图所示转化的是( )
 下表所列各组物质中,物质之间不能通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间不能通过一步反应就能实现如图所示转化的是( )| 物质 选项 | a | b | c |
| A | SiO2 | Na2SiO3 | H2SiO3 |
| B | C | CO | CO2 |
| C | Fe | FeCl2 | FeCl3 |
| D | CuO | Cu(OH)2 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
3.化学用语是学习化学的重要工具.下列用来表示物质变化的化学用语正确的是( )
| A. | 氢氧燃料电池的正极反应式为H2+2OH--2e-═2H2O | |
| B. | 用铂电极电解硫酸铜溶液的阳极反应式为4OH--4e-═O2↑+2H2O | |
| C. | 表示醋酸与NaOH的稀溶液反应的中和热的化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ.mol-1 | |
| D. | NaHSO3溶于水时水解的离子方程式为HSO3-+H2O?SO32-+H3O+ |
