题目内容
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下:

已知:2KOH+Cl2═KCl+KClO+H2O(条件:温度较低)
6KOH+3Cl2═5KCl+KClO3+3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺反应①应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度为 ;
(5)在“溶液I”中加KOH固体的目的是 :
A.与“溶液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为KClO
(6)从“反应液Ⅱ”中分离出K2FeO4后,还会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 (答1点即可); 则反应③中发生的离子反应方程式为 .
(7)如何判断K2FeO4晶体已经洗涤干净 .

已知:2KOH+Cl2═KCl+KClO+H2O(条件:温度较低)
6KOH+3Cl2═5KCl+KClO3+3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺反应①应在
(2)写出工业上制取Cl2的化学方程式
(3)K2FeO4具有强氧化性的原因
(4)配制KOH溶液时,是在每100mL水中溶解61.6g KOH固体(该溶液的密度为1.47g/mL),它的物质的量浓度为
(5)在“溶液I”中加KOH固体的目的是
A.与“溶液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为KClO
(6)从“反应液Ⅱ”中分离出K2FeO4后,还会有副产品
(7)如何判断K2FeO4晶体已经洗涤干净
考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:氢氧化钾溶液中充入足量氯气,在温度较低的条件下反应生成氯化钾、次氯酸钾和水,加入氢氧化钾固体除去KCl,得到碱性KClO的浓溶液,加入90%硝酸铁溶液发生反应生成高铁酸钾溶液Ⅱ纯化得到湿产品,洗涤干燥得到K2FeO4晶体;
(1)由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,由信息②可知温度较高KOH与Cl2 反应生成的是KClO3;
(2)工业是利用电解饱和食盐水制取氯气;
(3)K2FeO4中铁元素化合价为+6价,价态高;
(4)根据n=
计算出氢氧化钾的物质的量,溶液质量等于溶质质量与溶剂质量之和,利用V=
计算溶液体积,再根据c=
计算氢氧化钾溶液的物质的量浓度;
(5)由工艺流程可知,反应液I中有过量的Cl2反应,生成更多的KClO;
(6)由工艺流程及③可知,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl.KNO3可用于化肥,炸药等,反应③是次氯酸根离子在碱溶液中氧化铁离子为高铁酸根离子;
(7)判断K2FeO4晶体是否已经洗涤干净,设计实验检验洗涤液中是否含有氯离子设计实验验证.
(1)由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,由信息②可知温度较高KOH与Cl2 反应生成的是KClO3;
(2)工业是利用电解饱和食盐水制取氯气;
(3)K2FeO4中铁元素化合价为+6价,价态高;
(4)根据n=
| m |
| M |
| m |
| ρ |
| n |
| V |
(5)由工艺流程可知,反应液I中有过量的Cl2反应,生成更多的KClO;
(6)由工艺流程及③可知,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl.KNO3可用于化肥,炸药等,反应③是次氯酸根离子在碱溶液中氧化铁离子为高铁酸根离子;
(7)判断K2FeO4晶体是否已经洗涤干净,设计实验检验洗涤液中是否含有氯离子设计实验验证.
解答:
解:氢氧化钾溶液中充入足量氯气,在温度较低的条件下反应生成氯化钾、次氯酸钾和水,加入氢氧化钾固体除去KCl,得到碱性KClO的浓溶液,加入90%硝酸铁溶液发生反应生成高铁酸钾溶液Ⅱ纯化得到湿产品,洗涤干燥得到K2FeO4晶体;
(1)由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,由信息②可知温度较高KOH与Cl2 反应生成的是KClO3.由信息①可知,在低温下KOH与Cl2 反应生成的是KClO.故选择低温较低,故答案为:温度较低;
(2)工业是利用电解饱和食盐水制取氯气.反应方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(3)K2FeO4中铁元素化合价为+6价,价态高,易得电子,表现强氧化性,故答案为:K2FeO4中铁元素化合价为+6价,易得电子;
(4)61.6g KOH固体的物质的量为
=1.1mol,溶液的质量为100mL×1g/mL+61.6g=161.6g,所以溶液的体积为
=
L,所以氢氧化钾溶液的物质的量浓度为
=10mol/L,故答案为:10mol/L;
(5)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应,生成更多的KClO.
A、与过量的Cl2继续反应,生成更多的KClO,故A正确;
B、由信息②可知温度较高KOH与Cl2 反应生成的是KClO3,不利用KClO生成、浪费原料,故B错误;
C、由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,故C正确;
D、由信息可知,该条件下KClO3 不能转化为KClO,故D错误.
故选:AC;
(6)由工艺流程及③可知,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl.KNO3可用于化肥,炸药等,反应③中发生的离子反应方程式为:2Fe3++3ClO-+10 OH-=2FeO42-+3Cl-+5H2O;
故答案为:KNO3、KCl;KNO3可用于化肥,炸药等;2Fe3++3ClO-+10 OH-=2FeO42-+3Cl-+5H2O;
(7)判断K2FeO4晶体是否已经洗涤干净,设计实验检验洗涤液中是否含有氯离子设计实验验证;步骤为:取最后一次的洗涤液于试管中,先加稀硝酸、再加硝酸银溶液,无白色沉淀则已被洗净,反之则沉淀没有洗涤干净,
故答案为:取最后一次的洗涤液于试管中,先加稀硝酸、再加硝酸银溶液,无白色沉淀则已被洗净,反之则沉淀没有洗涤干净.
(1)由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,由信息②可知温度较高KOH与Cl2 反应生成的是KClO3.由信息①可知,在低温下KOH与Cl2 反应生成的是KClO.故选择低温较低,故答案为:温度较低;
(2)工业是利用电解饱和食盐水制取氯气.反应方程式为:2NaCl+2H2O
| ||
| ||
(3)K2FeO4中铁元素化合价为+6价,价态高,易得电子,表现强氧化性,故答案为:K2FeO4中铁元素化合价为+6价,易得电子;
(4)61.6g KOH固体的物质的量为
| 61.6g |
| 56g/mol |
| 161.6g |
| 1.47×103g/L |
| 161.6 |
| 1470 |
| 1.1mol | ||
|
(5)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应,生成更多的KClO.
A、与过量的Cl2继续反应,生成更多的KClO,故A正确;
B、由信息②可知温度较高KOH与Cl2 反应生成的是KClO3,不利用KClO生成、浪费原料,故B错误;
C、由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,故C正确;
D、由信息可知,该条件下KClO3 不能转化为KClO,故D错误.
故选:AC;
(6)由工艺流程及③可知,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl.KNO3可用于化肥,炸药等,反应③中发生的离子反应方程式为:2Fe3++3ClO-+10 OH-=2FeO42-+3Cl-+5H2O;
故答案为:KNO3、KCl;KNO3可用于化肥,炸药等;2Fe3++3ClO-+10 OH-=2FeO42-+3Cl-+5H2O;
(7)判断K2FeO4晶体是否已经洗涤干净,设计实验检验洗涤液中是否含有氯离子设计实验验证;步骤为:取最后一次的洗涤液于试管中,先加稀硝酸、再加硝酸银溶液,无白色沉淀则已被洗净,反之则沉淀没有洗涤干净,
故答案为:取最后一次的洗涤液于试管中,先加稀硝酸、再加硝酸银溶液,无白色沉淀则已被洗净,反之则沉淀没有洗涤干净.
点评:本题考查了物质制备与物质分离提纯的分析判断,实验过程的理解应用和基本操作的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
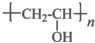 ,其工业合成路线如下:
,其工业合成路线如下: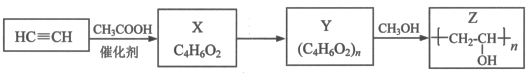

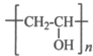 +
+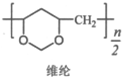 +
+

 实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示: 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
