题目内容
氧化锌是橡胶、油漆、搪瓷、电缆、医药、电子、化学等工业的重要原料.以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如下:

(1)浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、Co+、Mn2+等杂质.物质A的作用是调节溶液的pH至5.4,物质A最好选择 .
A.NH3.H2O B.Na2CO3 C.H2SO4 D.ZnO
已知25℃时部分金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH如下表:
该温度下Ksp[Zn(OH)2]= .
(2)KMnO4的作用是除去Mn2+和Fe2+,则KMnO4与Mn2+反应的离子方程式为 ;若溶液中c(Fe2+)=0.0005mol/L,则处理1m3该溶液,Fe2+所消耗的KMnO4的质量为 g(保留两位有效数字).
(3)杂质Cu2+、Co2+可利用置换反应除去,则物质B是 .
(4)被灼烧的沉淀是ZnCO3?2Zn(OH)2?H2O,生成该沉淀的化学方程式为 .如何检验该沉淀是否洗净? .

(1)浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、Co+、Mn2+等杂质.物质A的作用是调节溶液的pH至5.4,物质A最好选择
A.NH3.H2O B.Na2CO3 C.H2SO4 D.ZnO
已知25℃时部分金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH如下表:
| 金属离子 | 开始沉淀时溶液pH | 完全沉淀时溶液pH |
| Zn2+ | 5.4 | 6.4 |
| Fe2+ | 6.5 | 7.5 |
| Cu2+ | 4.2 | 6.7 |
| Co2+ | 6.6 | 7.6 |
(2)KMnO4的作用是除去Mn2+和Fe2+,则KMnO4与Mn2+反应的离子方程式为
(3)杂质Cu2+、Co2+可利用置换反应除去,则物质B是
(4)被灼烧的沉淀是ZnCO3?2Zn(OH)2?H2O,生成该沉淀的化学方程式为
考点:制备实验方案的设计,难溶电解质的溶解平衡及沉淀转化的本质,物质的分离、提纯和除杂
专题:电离平衡与溶液的pH专题
分析:氧化锌样品加入硫酸酸浸,浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、Co+、Mn2+等杂质,过滤除去不溶性杂质得到滤液A,加入A调节溶液PH,过滤加入高锰酸钾溶液氧化亚铁离子和锰离子,调节溶液PH生成氢氧化铁沉淀和二氧化锰沉淀,过滤得到滤液B为锌目的是发生置换反应生成铜和钴除去Cu2+、Co2+可,过滤得到滤液主要是锌离子的溶液,加入一水合氨和碳酸氢铵沉淀锌离子生成ZnCO3?2Zn(OH)2?H2O,洗涤灼烧得到成品;
(1)该流程的目的是制备氧化锌,所以为了不引入新的杂质,需要选择氧化锌调节溶液的pH值;Zn(OH)2完全沉淀时c(Zn2+)=1×10-5mol/L,c(OH-)=1×10-14/1×10-6.4=1×10-7.6mol/L,依据溶度积常数计算得到;
(2)根据流程图可知,加入高锰酸钾后有二氧化锰沉淀出现,所以KMnO4与Mn2+反应生成二氧化锰;根据得失电子守恒规律,结合离子方程式计算该溶液中n(Fe2+),得到需要KMnO4的质量;
(3)杂质Cu2+、Co2+可利用置换反应除去,同样是为了不能引入新的杂质,B应是锌粉;
(4)生成ZnCO3?2Zn(OH)2?H2O应是在加入碳酸氢铵与氨水后产生的,溶液中的硫酸锌与之反应生成的沉淀,结合原则守恒和产物配平书写化学方程式; 该沉淀中还可能含有硫酸根离子,所以检验洗涤是否干净的方法就是检验硫酸根离子是否存在;
(1)该流程的目的是制备氧化锌,所以为了不引入新的杂质,需要选择氧化锌调节溶液的pH值;Zn(OH)2完全沉淀时c(Zn2+)=1×10-5mol/L,c(OH-)=1×10-14/1×10-6.4=1×10-7.6mol/L,依据溶度积常数计算得到;
(2)根据流程图可知,加入高锰酸钾后有二氧化锰沉淀出现,所以KMnO4与Mn2+反应生成二氧化锰;根据得失电子守恒规律,结合离子方程式计算该溶液中n(Fe2+),得到需要KMnO4的质量;
(3)杂质Cu2+、Co2+可利用置换反应除去,同样是为了不能引入新的杂质,B应是锌粉;
(4)生成ZnCO3?2Zn(OH)2?H2O应是在加入碳酸氢铵与氨水后产生的,溶液中的硫酸锌与之反应生成的沉淀,结合原则守恒和产物配平书写化学方程式; 该沉淀中还可能含有硫酸根离子,所以检验洗涤是否干净的方法就是检验硫酸根离子是否存在;
解答:
解:(1)该流程的目的是制备氧化锌,所以为了不引入新的杂质,需要选择氧化锌 调节溶液的pH值;Zn(OH)2完全沉淀时c(Zn2+)=1×10-5mol/L,c(OH-)=1×10-14/1×10-6.4=1×10-7.6mol/L,所以该温度下Zn(OH)2的Ksp=c(OH-)2×c(Zn2+)=1.0×10-20.2 ;
故答案为:D,1.0×10-20.2 ;
(2)根据流程图可知,加入高锰酸钾后有二氧化锰沉淀出现,所以KMnO4与Mn2+反应生成二氧化锰,离子方程式为2MnO4-+3Mn2++2H2O=MnO2+4H+;根据得失电子守恒规律,存在MnO4-~3Fe2+,1m3的该溶液中n(Fe2+)=0.5mol,则需要KMnO4的质量为
×158g/mol=26.33g;
故答案为:2MnO4-+3Mn2++2H2O=MnO2+4H+;26.33g;
(3)杂质Cu2+、Co2+可利用置换反应除去,同样是为了不能引入新的杂质,B应是锌粉;
故答案为:锌粉;
(4)生成ZnCO3?2Zn(OH)2?H2O应是在加入碳酸氢铵与氨水后产生的,溶液中的硫酸锌与之反应生成的沉淀,所以化学方程式为3ZnSO4+5NH3?H2O+NH4HCO3=ZnCO3?2Zn(OH)2?H2O↓+3 (NH4)2SO4; 该沉淀中还可能含有硫酸根离子,所以检验洗涤是否干净的方法就是检验硫酸根离子是否存在,具体操作为向最后一次的洗涤液中滴入1~2滴BaCl2溶液,若无明显的现象,则沉淀已洗净,
故答案为:3ZnSO4+5NH3?H2O+NH4HCO3=ZnCO3?2Zn(OH)2?H2O↓+3 (NH4)2SO4;向最后一次的洗涤液中滴入1~2滴BaCl2 溶液,若无明显的现象,则沉淀已洗净.
故答案为:D,1.0×10-20.2 ;
(2)根据流程图可知,加入高锰酸钾后有二氧化锰沉淀出现,所以KMnO4与Mn2+反应生成二氧化锰,离子方程式为2MnO4-+3Mn2++2H2O=MnO2+4H+;根据得失电子守恒规律,存在MnO4-~3Fe2+,1m3的该溶液中n(Fe2+)=0.5mol,则需要KMnO4的质量为
| 0.5mol |
| 3 |
故答案为:2MnO4-+3Mn2++2H2O=MnO2+4H+;26.33g;
(3)杂质Cu2+、Co2+可利用置换反应除去,同样是为了不能引入新的杂质,B应是锌粉;
故答案为:锌粉;
(4)生成ZnCO3?2Zn(OH)2?H2O应是在加入碳酸氢铵与氨水后产生的,溶液中的硫酸锌与之反应生成的沉淀,所以化学方程式为3ZnSO4+5NH3?H2O+NH4HCO3=ZnCO3?2Zn(OH)2?H2O↓+3 (NH4)2SO4; 该沉淀中还可能含有硫酸根离子,所以检验洗涤是否干净的方法就是检验硫酸根离子是否存在,具体操作为向最后一次的洗涤液中滴入1~2滴BaCl2溶液,若无明显的现象,则沉淀已洗净,
故答案为:3ZnSO4+5NH3?H2O+NH4HCO3=ZnCO3?2Zn(OH)2?H2O↓+3 (NH4)2SO4;向最后一次的洗涤液中滴入1~2滴BaCl2 溶液,若无明显的现象,则沉淀已洗净.
点评:本题考查对流程的分析,溶度积的计算,化学方程式、离子方程式的判断与书写,氧化还原反应的计算,洗涤操作的判断,题目难度中等.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
能用来鉴别乙醇、己烷、己烯三种无色溶液的一种试剂是( )
| A、金属钠 | B、溴水 |
| C、氢溴酸 | D、氢氧化钠溶液 |
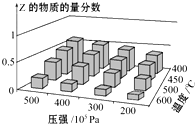 为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )| A、△H>0 a+b>c |
| B、△H<0 a+b<c |
| C、△H<0 a+b>c |
| D、△H>0 a+b<c |
二十世纪化学合成技术的发展对人类健康水平和生活质量的提高做出了巨大贡献.下列各组物质全部为合成高分子材料的是( )
| A、纤维素、涤纶 |
| B、麦芽糖、胰岛素 |
| C、有机玻璃、酚醛树脂 |
| D、淀粉、硫化橡胶 |
实验室里不同化学试剂的保存方法不尽相同,①NaOH溶液 ②大理石 ③NaCl溶液 ④硝酸4种试剂通常各自存放在如图所示的玻璃试剂瓶中.按照试剂瓶的顺序存放试剂序号正确的是( )
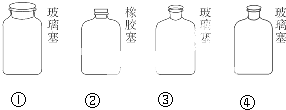

| A、①②③④ | B、②①④③ |
| C、②③④① | D、②①③④ |

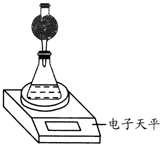 某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol?L-1 HNO3、2.00mol?L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol?L-1 HNO3、2.00mol?L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
