题目内容
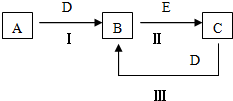 A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.
A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.(1)若A是能使湿润的红色试纸变蓝的气体;C、D均为空气的主要成分,E是一种无色无味的有毒气体.
①写出E的化学式
②写出反应Ⅰ的化学方程式
(2)若A是淡黄色化合物;常温下D是无色气体;C中含有的阴、阳离子均为10电子粒子
①写出A的电子式
②写出反应Ⅱ的化学方程式
(3)若A是地壳中含量最多的金属,B在火焰上灼烧时火焰呈黄色,B与C中均含有A元素,且B与C在溶液中混合时能生成白色沉淀①写出B的化学式
(4)若A是黑色粉末,常温下B是黄绿色气体,C溶液呈碱性,有漂白性.写出反应Ⅲ的离子方程式
考点:无机物的推断
专题:推断题
分析:(1)A是能使湿的红色石蕊试纸变蓝的气体,为NH3;C、D均为空气的主要成分,为N2、O2,而D与氨气反应得到B,故D为O2,B为NO,C为N2,E是一种无色无味有毒气体,NO与E反应得到N2,E具有还原性,为CO,验证符合转化关系;
(2)A是淡黄色化合物,常见淡黄色固体化合物是过氧化钠和溴化银,常温下D是无色气体,A能和D反应,所以A是过氧化钠,D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,B和E反应生成C,C中含有的阴、阳离子均为10电子粒子,C能和二氧化碳反应生成B,所以B是碳酸钠,C是氢氧化钠,E是强碱(如氢氧化钙、氢氧化钡),验证符合转化关系;
(3)若A是地壳中含量最多的金属,则A为Al,B在火焰上灼烧时火焰呈黄色,含有Na元素,B与C中均含有A元素,且B与C在溶液中混合时能生成白色沉淀,可推知D为NaOH、B为NaAlO2、E为强酸、C为铝盐;
(4)若A是黑色粉末,常温下B是黄绿色气体,则A为二氧化锰、D为浓盐酸、B为氯气、E为强碱,C为次氯酸盐.
(2)A是淡黄色化合物,常见淡黄色固体化合物是过氧化钠和溴化银,常温下D是无色气体,A能和D反应,所以A是过氧化钠,D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,B和E反应生成C,C中含有的阴、阳离子均为10电子粒子,C能和二氧化碳反应生成B,所以B是碳酸钠,C是氢氧化钠,E是强碱(如氢氧化钙、氢氧化钡),验证符合转化关系;
(3)若A是地壳中含量最多的金属,则A为Al,B在火焰上灼烧时火焰呈黄色,含有Na元素,B与C中均含有A元素,且B与C在溶液中混合时能生成白色沉淀,可推知D为NaOH、B为NaAlO2、E为强酸、C为铝盐;
(4)若A是黑色粉末,常温下B是黄绿色气体,则A为二氧化锰、D为浓盐酸、B为氯气、E为强碱,C为次氯酸盐.
解答:
解:(1)A是能使湿的红色石蕊试纸变蓝的气体,为NH3;C、D均为空气的主要成分,为N2、O2,而D与氨气反应得到B,故D为O2,B为NO,C为N2,E是一种有毒气体,NO与E反应得到N2,E具有还原性,为CO,验证符合转化关系,
①E的化学式为CO,故答案为:CO;
②反应Ⅰ的化学方程式为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(2)A是淡黄色化合物,常见淡黄色固体化合物是过氧化钠和溴化银,常温下D是无色气体,A能和D反应,所以A是过氧化钠,D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,B和E反应生成C,C中含有的阴、阳离子均为10电子粒子,C能和二氧化碳反应生成B,所以B是碳酸钠,C是氢氧化钠,E是强碱(如氢氧化钙、氢氧化钡),验证符合转化关系,
①A为过氧化钠,电子式为 ,故答案为:
,故答案为: ;
;
②反应Ⅱ的化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,故答案为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)若A是地壳中含量最多的金属,则A为Al,B在火焰上灼烧时火焰呈黄色,含有Na元素,B与C中均含有A元素,且B与C在溶液中混合时能生成白色沉淀,可推知D为NaOH、B为NaAlO2、E为强酸、C为铝盐,反应Ⅲ的离子方程式为:Al3++4OH-=AlO2-+2H2O,故答案为:NaAlO2;Al3++4OH-=AlO2-+2H2O;
(4)若A是黑色粉末,常温下B是黄绿色气体,则A为二氧化锰、D为浓盐酸、B为氯气、E为强碱,C为次氯酸盐,反应Ⅲ的离子方程式为:H++Cl-+ClO-=Cl2↑+H2O,
故答案为:H++Cl-+ClO-=Cl2↑+H2O.
①E的化学式为CO,故答案为:CO;
②反应Ⅰ的化学方程式为:4NH3+5O2
| ||
| △ |
| ||
| △ |
(2)A是淡黄色化合物,常见淡黄色固体化合物是过氧化钠和溴化银,常温下D是无色气体,A能和D反应,所以A是过氧化钠,D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,B和E反应生成C,C中含有的阴、阳离子均为10电子粒子,C能和二氧化碳反应生成B,所以B是碳酸钠,C是氢氧化钠,E是强碱(如氢氧化钙、氢氧化钡),验证符合转化关系,
①A为过氧化钠,电子式为
 ,故答案为:
,故答案为: ;
;②反应Ⅱ的化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,故答案为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)若A是地壳中含量最多的金属,则A为Al,B在火焰上灼烧时火焰呈黄色,含有Na元素,B与C中均含有A元素,且B与C在溶液中混合时能生成白色沉淀,可推知D为NaOH、B为NaAlO2、E为强酸、C为铝盐,反应Ⅲ的离子方程式为:Al3++4OH-=AlO2-+2H2O,故答案为:NaAlO2;Al3++4OH-=AlO2-+2H2O;
(4)若A是黑色粉末,常温下B是黄绿色气体,则A为二氧化锰、D为浓盐酸、B为氯气、E为强碱,C为次氯酸盐,反应Ⅲ的离子方程式为:H++Cl-+ClO-=Cl2↑+H2O,
故答案为:H++Cl-+ClO-=Cl2↑+H2O.
点评:本题考查无机物推断,需要学生熟练掌握元素化合物性质,题目难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
下列叙述正确的是( )
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤元素的非金属性越强,其氧化物对应的水化物酸性就越强
⑥已知2H2(g)+O2(g)═2H2O(l)△H=-571kJ?mol-1则氢气的燃烧热为285.8kJ?mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤元素的非金属性越强,其氧化物对应的水化物酸性就越强
⑥已知2H2(g)+O2(g)═2H2O(l)△H=-571kJ?mol-1则氢气的燃烧热为285.8kJ?mol-1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.
| A、只有②④⑥ |
| B、只有①⑥⑦ |
| C、只有②③④ |
| D、只有③⑤⑦ |
下列叙述错误的是( )
| A、米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质 |
| B、向油脂发生皂化反应后所得的混合溶液中加入固体NaCl会出现分层现象,此过程发生的主要是物理变化 |
| C、纤维素的水解实验操作为:把一小团棉花放入试管中,加入几滴90%的硫酸溶液,用玻璃棒把棉花捣成糊状,小火微热,至成亮棕色溶液 |
| D、油脂、乙醇是人体必需的营养物质 |
下列说法正确的是( )
| A、苯和溴水振荡后,由于发生化学反应而使溴水的水层颜色变浅 |
| B、酸性高锰酸钾溶液和溴水都既能鉴别出甲烷和乙烯又能除去甲烷中含有的乙烯再经干燥而获得纯净的甲烷 |
| C、煤中含有苯和甲苯,可以用先干馏,后蒸馏的方法把它们分离出来 |
| D、石油中含有C5~C11的烷烃,可以通过分馏得到汽油 |
钠及其化合物的下列用途与化学性质有关的是( )
| A、制焰火 |
| B、作原子反应堆的导热剂 |
| C、冶炼金属钛 |
| D、应用在电光源 |
在25℃时.密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:
下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol?-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、改变温度可以改变此反应的平衡常数 |
| C、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D、反应可表示为X+3Y?2Z,其平衡常数为1600 |
