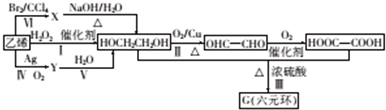
题目内容
7.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
| A. | 铜电极上发生反应Cu-2e-=Cu2+ | |
| B. | 工作一段时间后,乙池的c(SO42-)减小 | |
| C. | 电流从铜极经过导线移向锌极 | |
| D. | 电池工作一段时间后,甲池的c(Zn2+)增加 |
分析 由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn发生氧化反应,为负极,Cu电极上发生还原反应,为正极,阳离子交换膜只允许阳离子和水分子通过,两池溶液中硫酸根浓度不变,随反应进行,甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大.
解答 解:A.由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn为负极,发生氧化反应,Cu为正极,发生还原反应,故A错误;
B.阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,故B错误;
C.电流从正极铜极经过导线移向负极锌极,故C正确;
D.甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液电荷守恒,甲池的c(Zn2+)不变,故D错误;
故选:C.
点评 本题考查原电池工作原理,比较基础,注意阳离子交换膜不允许阳离子通过,D选项利用电荷守恒分析.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
18.下列不能形成配位键的是( )
| A. | Ag+ NH3 | B. | Cu2+ NH3 | C. | H+ H2O | D. | Ag+ CH4 |
15.某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
| A. | Cl-和NH3分子均与Pt4+配位 | |
| B. | 该配合物可能是平面正方形结构 | |
| C. | 配合物中中心原子的电荷数和配位数均为6 | |
| D. | 配合物中Cl-与Pt4+配位,而NH3分子不配位 |
12.胶体分散系与其它分散系的本质差别是( )
| A. | 是否有丁达尔现象 | B. | 分散质粒子是否带电 | ||
| C. | 是否稳定 | D. | 分散质直径大小 |
 .
. .
.
 .
.